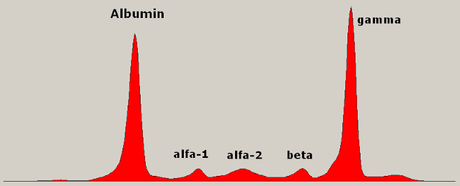
Electophorèse des protéines du sérum montrant une paraprotéine (pic dans la zone gamma) d'un patient atteint d'un myélome multiple.
Source iconographique et légendaire: https://fr.wikipedia.org/wiki/Myélome
L'analyse principale de l'étude ICARIA-MM a montré une amélioration significative de la survie sans progression avec l'ajout d'isatuximab au pomalidomide-dexaméthasone dans le myélome multiple récidivant et réfractaire. Ici, nous rapportons l’analyse de survie globale comme prévu par le protocole, à 24 mois après l'analyse primaire.
Dans cette étude randomisée, multicentrique, en ouvert, de phase 3, des patients adultes (âgés de ≥ 18 ans) atteints d'un myélome multiple récidivant et réfractaire qui avaient reçu au moins deux lignes de traitement antérieures, y compris le lénalidomide et un inhibiteur du protéasome, et avaient un indice de performance ECOG (Eastern Cooperative Oncology Group) de 0 à 2 ont été recrutés dans 102 hôpitaux de 24 pays d'Europe, d'Amérique du Nord et des régions Asie-Pacifique. Les patients étaient exclus s'ils avaient une maladie réfractaire aux anti-CD38 ou s'ils avaient déjà reçu du pomalidomide. Les patients ont été répartis au hasard (1:1), à l'aide d'une technologie de réponse interactive avec randomisation par blocs permutés (taille de bloc de quatre) et stratifiés selon le nombre de lignes de traitement précédentes (2–3 versus > 3) et l'âge (<75 versus≥75 ans ), pour recevoir l’isatuximab–pomalidomide–dexaméthasone (groupe isatuximab) ou le pomalidomide–dexaméthasone (groupe témoin). Dans le groupe isatuximab, l'isatuximab 10 mg/kg par voie intraveineuse a été administré les jours 1, 8, 15 et 22 du premier cycle de 4 semaines, puis les jours 1 et 15 des cycles suivants. Les deux groupes ont reçu 4 mg de pomalidomide par voie orale les jours 1 à 21 de chaque cycle, et 40 mg de dexaméthasone par voie orale ou intraveineuse hebdomadaire (20 mg si âgé de ≥ 75 ans) les jours 1, 8, 15 et 22 de chaque cycle. Le traitement a été poursuivi jusqu'à progression de la maladie, toxicité inacceptable ou retrait du consentement. Nous rapportons ici une seconde analyse intermédiaire comme prévu par le protocole de la survie globale (délai entre la randomisation et le décès toutes causes confondues), critère d'évaluation secondaire clé, dans la population en intention de traiter (c'est-à-dire tous les patients ayant fourni un consentement éclairé et attribué un numéro de randomisation) à 24 mois après l'analyse primaire. L'innocuité a été évaluée chez tous les patients ayant reçu au moins une dose ou partie de dose du traitement à l'étude. La limite d'arrêt prédéfinie pour l'analyse de la survie globale était lorsque la valeur p dérivée était égale ou inférieure à 0,0181.
Entre le 10 janvier 2017 et le 2 février 2018, 387 patients ont été examinés pour inclusion et 307 ont été assignés au hasard soit au groupe isatuximab (n = 154) soit au groupe témoin (n = 153). La durée médiane de suivi à la date de clôture de la base de données (1eroctobre 2020) était de 35,3 mois (Intervalle Interquartle [IQR] 33·5–37·4). La durée médiane de survie globale était de 24,6 mois (Intervalle de Confiance [IC]95 % 20,3–31,3) dans le groupe isatuximab et de 17,7 mois (14,4–26,2) dans le groupe contrôle (hazard ratio 0,76 [95 % IC 0,57–1,01] ; log-rank unilatéral p=0·028, ne franchissant pas la limite d'arrêt prédéfinie). Les effets indésirables les plus fréquents de grade 3 ou pire apparus sous traitement dans le groupe isatuximab par rapport au groupe témoin étaient la neutropénie (76 [50 %] des 152 patients contre 52 [35 %] des 149 patients), la pneumonie (35 [23 %] contre 31 [21 %]) et thrombocytopénie (20 [13 %] vs 18 [12 %]). Des événements indésirables graves apparus sous traitement ont été observés chez 111 (73 %) patients du groupe isatuximab et 90 (60 %) patients du groupe témoin. Deux (1 %) décès liés au traitement sont survenus dans le groupe isatuximab (un dû à une septicémie et un à un infarctus cérébelleux) et deux (1 %) sont survenus dans le groupe témoin (un dû à une pneumonie et un à une infection des voies urinaires).
L'ajout d'isatuximab plus pomalidomide-dexaméthasone a entraîné une différence de 6,9 mois dans la survie globale médiane par rapport au pomalidomide-dexaméthasone et constitue une nouvelle norme de soins pour le myélome multiple réfractaire au lénalidomide et réfractaire aux inhibiteurs du protéasome ou en rechute. Le suivi final de l'analyse de survie globale est en cours. Prof Paul G Richardson, MD, et al, dans The Lancet Oncology, publication en ligne en avant-première, 10 février 2022
Financement : Sanofi
Source : The Lancet Online / Préparation post : NZ
