La notion de salinité C'est le caractère essentiel de l'eau de mer. L'océan contient en moyenne 35 grammes de sel par kilogramme d'eau de mer. Si on considère le volume total de l'océan (1370 millions de km3) cela représente 48 millions de milliards de tonnes de sel, soit 95 tonnes par m² sur le globe entier, ou 320 tonnes par m²sur les parties émergées. La présence de sel dans l'eau modifie certaines propriétés (densité, compressibilité, point de congélation, température du maximum de densité). D'autres (viscosité, absorption de la lumière) ne sont pas influencées de manière significative. Enfin certaines sont essentiellement déterminées par la quantité de sel dans l'eau (conductivité, pression osmotique). Le chlorure de sodium (Na Cl) n'est qu'un des très nombreux sels composant
la solution. On a décelé dans l'eau de mer 60 des 92 corps simples existant à l'état naturel. Certains n'ont peut-être pas encore étés découverts, car ils existeraient en trop faible quantité. En effet certains corps ne sont décelables qu'après avoir été concentrés par des organismes marins ayant un pouvoir de concentration de 103 à 107 , citons par exemple le cobalt (homards et moules), le nickel (certains mollusques), le plomb (cendres d'organismes marins).
On donne dans le tableau suivant les principaux composants d'une eau de mer de salinité 35 :
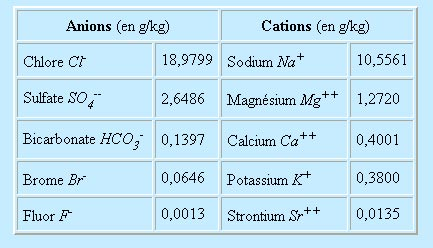
Le PH de cette solution est voisin de 8,2 (légèrement alcalin). Les gaz dissous sont constitués à 64% d'azote et 34% d'oxygène. Les concentrations diminuent quand la température et la salinité augmentent. La proportion de CO2 est 60 plus forte dans la mer que dans l'air (1,8% au lieu de 0,03%). L'océan apparaît donc comme un régulateur de la teneur en CO2 de l'atmosphère. Un aspect important de l'eau de mer est que si la concentration totale des sels dissous varie en fonction du lieu, la proportion des composants les plus importants reste à peu près constante. Cela tend à prouver que sur une échelle de temps géologique, les océans ont été bien mélangés, c'est à dire que malgré les circulations particulières à chaque océan, l'eau circule entre les différents océans.
Mais la concentration totale peut varier d'un endroit à l'autre et d'une profondeur à l'autre. Il existe des processus continus pour concentrer et dissoudre l'eau de mer en certaines régions. Ce sont ces processus qui nous intéressent. Définitions de la salinitéIl n'existe pas une mais plusieurs définitions de la salinité : une définition purement théorique et plusieurs définitions pratiques, liées aux méthodes de mesure. Définition théorique : La salinité est la quantité totale des résidus solides (en grammes) contenu dans 1 kg d'eau de mer, quand tous les carbonates ont été transformés en oxydes, le brome et l'iode remplacé par le chlore et que toute la matière organique a été oxydée.
Il est très difficile d'estimer la salinité par analyse chimique directe (séchage et pesée du résidu solide), car certains corps présents, notamment les chlorures, s'échappent au cours du dernier stade de séchage. On utilise le fait que, dans l'eau de mer, les proportions relatives des principaux constituants sont pratiquement constantes. Le dosage de l'un d'entre eux est donc susceptible de donner la teneur de tous les autres, ainsi que
la salinité. Les ions chlore, brome et iode peuvent aisément être dosés, avec précision, par titrage au nitrate d'argent. La relation entre la salinité et la chlorinité a été définie en 1902 à partir de nombreuses mesures de laboratoires sur des échantillons provenant de toutes les mers du globe. La chlorinité étant la quantité (en g/kg) d'ions chlore, brome et iode qui tout trois sont précipités lors du titrage au nitrate d'argent. S = 0,03 + 1,805 Cl S salinité , Cl chlorinité. Un inconvénient majeur est que cette formule donne une salinité de 0,03 pour une chlorinité nulle. L'UNESCO a donc proposé en 1969 une nouvelle formule définissant ce qu'on appelle la salinité absolue :
S = 1,80655 Cl Ces définitions ont été revues quand de nouvelles techniques permettant de déterminer la salinité à partir de mesure de conductivité, température et pression, furent développées. Depuis 1978 l'échelle pratique de salinité définie la salinité en terme de rapport de conductivité : La salinité pratique (symbole S), d'un échantillon d'eau de mer, est définie en fonction du rapport K de la conductivité électrique de cet échantillon d'eau de mer à 15°C et à la pression atmosphérique normale, et de celle d'une solution de chlorure de potassium dans laquelle la fraction en masse de KCl est 0,0324356, à la même température et même pression. Une valeur de K égale à 1 correspond par définition à une salinité pratique égale à 35. La formule correspondante est :
S = 0,0080 -0,1692 K1/2 + 25,3853 K + 14,0941 K3/2 - 7,0261 K2 + 2,7081 K5/2 On peut trouver quelques différences entre toutes ces définitions, mais elles sont en général négligeables. Par contre dans le cas où la composition de l'eau de mer n'est pas “standard”, (par exemple à proximité des fleuves) seule l'analyse chimique (séchage et pesée) donne un résultat valable. Unité : Depuis l'introduction de l'échelle pratique de salinité, la salinité n'est plus définie comme un rapport de masse et s'exprime sans unité (comme par exemple le PH). On trouve encore dans la littérature des valeurs de salinité exprimées en o/oo ou en g/kg ou encore en psu (practical salinity unit).
