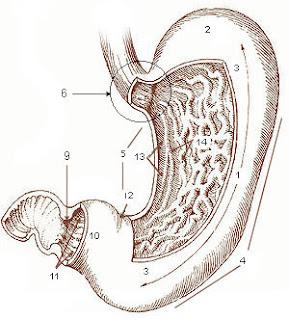
Anatomie de l'estomac. On distingue notamment le corps de l'estomac [1] et le cardia [6] (ou jonction gastro-oesophagienne).
Source iconographique et légendaire: https://fr.wikipedia.org/wiki/Endobrachyoesophage
Dans l'étude mondiale de phase 3 RAINBOW, le ramucirumab plus paclitaxel a significativement amélioré la survie globale par rapport au placebo plus paclitaxel chez les patients atteints d'un adénocarcinome gastrique ou de la jonction gastrique ou gastro-œsophagienne (JGE) avancé. RAINBOW-Asia, une étude de transition avec une conception similaire à RAINBOW, visait à évaluer l'efficacité et l'innocuité du ramucirumab plus paclitaxel pour l'adénocarcinome gastrique avancé ou JGE chez les patients asiatiques, principalement chinois.
RAINBOW-Asia était un essai de phase 3 randomisé, en double aveugle, contrôlé par placebo, réalisé dans 32 centres en Chine, en Malaisie, aux Philippines et en Thaïlande. Les patients adultes (≥ 18 ans) atteints d'un adénocarcinome gastrique métastatique ou localement avancé, non résécable ou d'un JGE qui ont déjà reçu une chimiothérapie à base de fluoropyrimidine-platine ont été randomisés avec un système de réponse Web interactif centralisé dans un rapport 2:1 pour recevoir du ramucirumab 8 mg/kg ou un placebo par voie intraveineuse les jours 1 et 15 plus paclitaxel 80 mg/m2 par voie intraveineuse les jours 1, 8 et 15 de chaque cycle de 28 jours. La randomisation a été stratifiée en fonction du statut de performance de l'Eastern Cooperative Oncology Group (ECOG) et de la présence de métastases péritonéales. Les co-critères principaux étaient la survie sans progression et la survie globale. Des analyses d'efficacité ont été effectuées dans la population en intention de traiter, et l'analyse de l'innocuité a inclus des patients ayant reçu au moins une dose du traitement à l'étude. Cet essai (…) est à ce jour achevé.
Entre le 2 mars 2017 et le 30 juin 2020, 440 patients ont été randomisés pour recevoir du ramucirumab plus paclitaxel (n=294) ou un placebo plus paclitaxel (n=146). La survie médiane sans progression était de 4,14 mois (Intervalle de Confiance [IC] 95 % 3,71–4,30) dans le groupe ramucirumab plus paclitaxel par rapport à 3,15 mois (2,83–4,14) dans le groupe placebo plus paclitaxel (risque relatif [RR] 0,765, IC 95 % 0,613-0,955, p=0,0184). La survie globale médiane était de 8,71 mois (IC 95 % 7,98-9,49) dans le groupe ramucirumab plus paclitaxel et de 7,92 mois (6,31-9,10) dans le groupe placebo plus paclitaxel (RR 0,963, IC à 95 % 0,771-1,203, p=0,7426). Les événements indésirables de grade 3 ou pire survenus pendant le traitement les plus fréquents ont été une diminution du nombre de neutrophiles (159 [54 %] des 293 patients dans le groupe ramucirumab plus paclitaxel vs 56 [39 %] des 145 dans le groupe placebo plus paclitaxel), une diminution du sang blanc numération cellulaire (127 [43%] vs42 [29 %]), anémie (46 [16%] vs 24 [17%]), hypertension (21 [7%] vs neuf [6%]) et neutropénie fébrile (18 [6%] vs un [<1%]).
Ces résultats, ainsi que les résultats de RAINBOW, soutiennent l'utilisation du ramucirumab plus paclitaxel comme traitement de deuxième intention dans une population à prédominance chinoise présentant un adénocarcinome gastrique avancé ou GEJ. Prof Rui-Hua Xu, MD, et al, dans The Lancet Gastroenterology & Hepatology, publication en ligne en avant-première, 6 octobre 2021
Financement : Eli Lilly and Company, USA
Source: The Lancet Online / Préparation post: NZ
