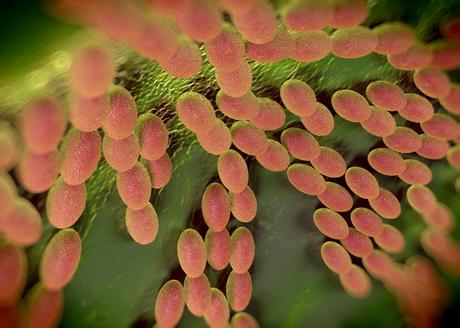
Les microbes intestinaux se nourrissent les uns les autres pour surmonter les carences alimentaires, et modifier le comportement de l'hôte, révèle cette recherche d’une équipe du Champalimaud Centre for the Unknown (Lisbonne). Ce processus d’alimentation métabolique croisée, décrypté chez la mouche des fruits et décrit dans la revue Nature Communications, permet aux bactéries intestinales de surmonter les carences alimentaires. En décryptant ces interactions, les chercheurs améliorent aussi la compréhension du fameux axe intestin-cerveau.
On sait aujourd’hui que le microbiome affecte le comportement de l’hôte, mais comment ? Cette équipe de chercheurs a regardé, chez mouche des fruits à l’aide de technologies de pointe, comment 2 bactéries intestinales s’entraident via la mise en œuvre d’une alimentation croisée, de manière à pouvoir prospérer même en cas de carence en nutriments essentiels à leur croissance.
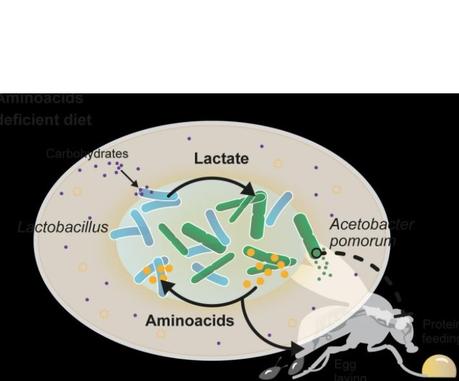
La bonne combinaison de bactéries permet la résilience du microbiome
aux carences alimentaires et cette résilience permet de limiter les modifications des fonctions cérébrales et des comportements.
Un apport équilibré en acides aminés essentiels au bien-être et à la santé des humains et des animaux. Les acides aminés essentiels sont les éléments constitutifs des protéines, mais ils influencent également ce que les animaux décident de manger. L’équipe de Lisbonne avait déjà montré que le microbiome joue un rôle clé dans la détermination de la manière dont les acides aminés affectent le cerveau.
Du fameux axe intestin-cerveau : les scientifiques apportent ici une nouvelle compréhension de l’influence du microbiome intestinal sur la santé cérébrale : les bactéries ne peuvent affecter les décisions de la mouche que lorsqu'elles sont présentes dans des combinaisons spécifiques. Il est bien connu que le microbiome contient souvent de nombreuses espèces différentes de bactéries, mais pourquoi différents types de bactéries sont nécessaires pour influencer le fonctionnement du cerveau et modifier la physiologie de l'hôte restait un mystère. « Ici, la mouche et son microbiome moins complexe que celui de l’Homme nous ont permis de disséquer précisément les mécanismes utilisés par le microbiote pour influer sur les décisions alimentaires de l'hôte ».
De la carence au comportement : les mouches privées d'acides aminés essentiels uniques développent un appétit plus aiguisé pour les aliments riches en protéines. Cependant, chez les mouches présentant des niveaux élevés de 2 bactéries dans leur microbiome (Acetobacter pomorum et Lactobacillus plantarum), cette préférence pour les protéines se trouve considérablement réduite et ces mouches vont même jusqu’à préférer le sucre. L’abondance dans le microbiote d’une seule de ces bactéries ne réduit pas l'appétit pour les protéines. Une combinaison de 2 espèces bactériennes s’avère nécessaire à produire cet effet.
La communauté plutôt que des bactéries isolées exerce donc un effet sur le comportement de l'hôte- et cela très probablement en raison de substances spécifiques ou métabolites produits par ces bactéries, expliquent les chercheurs. C’est le concept d’alimentation métabolique croisée. Il s’agit donc de pouvoir cartographier ces interactions métaboliques établies entre les bactéries dans le microbiome et de déterminer comment ces interactions peuvent affecter le comportement.
Dans cette expérience sur la mouche, un capteur mis au point en laboratoire, « le flyPAD » a permis de mesurer avec une infinie précision le schéma d'alimentation de chaque mouche. Des bactéries « mutantes » ont ensuite été développées pour comprendre l'impact de fonctions spécifiques des cellules bactériennes sur le comportement de l'hôte. Enfin, avec l’aide de la «métabolomique à résolution isotopique», les scientifiques ont pu suivre les métabolites échangés entre les deux bactéries différentes.
Une syntrophie entre bactéries : cette relation symbiotique entre deux espèces bactériennes permet de préserver l’équilibre du microbiote et des comportements. Ici, les scientifiques observent que les souches de Lactobacillus produisent du lactate qui est utilisé par les souches d'Acetobacter (Sur visuel) pour synthétiser des acides aminés et d'autres métabolites. Ceux-ci sont ensuite utilisés par la souche Lactobacillus qui ne peut pas les synthétiser pour continuer à produire du lactate. De plus, ces acides aminés bactériens sont très probablement utilisés par l'animal pour la production d'œufs. Le lactate utilisé par la bactérie Acetobacter influe ainsi sur le comportement de la mouche ! En établissant cette relation d'alimentation croisée, la communauté bactérienne devient résiliente aux changements alimentaires drastiques, ce qui préserve sa croissance même en cas de carence en nutriments essentiels à la survie.
« Il est bien établi que notre régime alimentaire affecte à la fois le microbiome et le cerveau. Ce qui rend cette relation complexe c'est que le microbiome affecte à son tour la façon dont le régime alimentaire nous affecte et ce que nous (ou les animaux) décidons de manger. Nous montrons ici que les bonnes associations de bactéries peuvent apporter au microbiome une résilience aux perturbations alimentaires. C'est aussi un bel exemple de la façon dont la nature établit des économies circulaires où rien n'est gaspillé ».
Source: Nature Communications 25 August 2020 DOI : 10.1038/s41467-020-18049-9 Metabolic cross-feeding in imbalanced diets allows gut microbes to improve reproduction and alter host behaviour
Plus sur Microbiote Blog
Équipe de rédaction SantélogSep 10, 2020Rédaction Santé log
