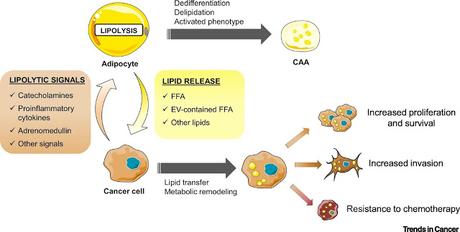
Progression Tumorale Alimentée par la Captation par les Cellules Tumorales de Lipides Relâchés par les Adipocytes au Niveau du Front Invasif de la Tumeur Les cellules tumorales relâchent des signaux lipolytiques (c’est-à-dire des catécholamines, cytokines proinflammatoires, adrénomédullines, autres signaux inconnus) pour transformer les adipocytes en adipocytes associés au cancer (CAAs) présentant une dédifférenciation, une délipidation, ainsi qu’un phénotype activé. La délipidation est principalement due à une capacité propre aux cellules cancéreuses à d’activer la lipolyse dans les adipocytes. De leur côté, les adipocytes libèrent des acides gras libres (FFA) (et potentiellement d’autres lipides), mais aussi des FFAs à partir de vésicules extracellulaires. Ces lipides sont internalisés par les cellules tumorales et déclenchent la reprogrammation métabolique alimentant la progression tumorale.
Au cours de la dernière décennie, il est devenu apparent que la reprogrammation métabolique représente un évènement clé de la progression tumorale. Le microenvironnement tumoral (TME) est une source de métabolites pour les cellules tumorales. Les adipocytes matures gorgés de lipides se logent fréquemment à proximité de tumeurs invasives, chez l’homme, et relâchent des acides gras libres (FFA) lipolyse. Ces FFAs sont captés par les cellules tumorales et utilisés pour alimenter la progression tumorale par divers mécanismes, dont l’oxydation mitochondriale des acides gras (FAO). Cette revue discute des avancées récentes dans notre compréhension de cette symbiose métabolique existant entre adipocytes et cellules cancéreuses et souligne les différences de cette diaphonie métabolique entre les différents types de cancer et leur localisation. Camille Attané, Catherine Müller, dans Trends in Cancer, publication en ligne en avant-première, 26 mars 2020
Source iconographique, légendaire et rédactionnelle : Science Direct / Traduction et adaptation : NZ
