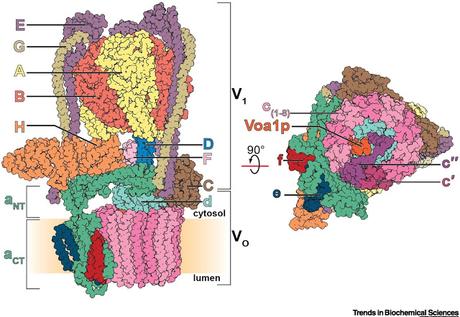
Structure et Arrangement des Sous-Unités de la V-ATPase de Levure
Les sous-unités de la région soluble V1sont désignées par des lettres majuscules, alors que les sous-unités de la région V0 incorporée dans une membrane sont désignées par des lettres minuscules. Les sous-unités A (jaune) et B (rouge) forment trois assemblages catalytiques par paires qui se lient à l’ATP et l’hydrolysent, avec pour résultat des changements induisant des rotations de la tige centrale qui est composée des sous-unités D (bleu), F (lila) et d (cyan). La sous-unité E (pourpre) et G (brun roux), forment trois tiges périphériques qui mettent les régions V1 et V0 par des interactions avec les sous-unités C (brun), H (orange), et le domaine N-terminal (NT) soluble de la sous-unité a (aNT). Le domaine C-terminal (CT) de la sous-unité a (aCT, vert) contient deux demi-chaînes de transport de protons décalées. L’anneau c est composé de huit sous-unités c promoteur (rose clair et rose foncé), sous-unités c’ (magenta), et sous unités c’’ (pourpre). La région V0 incorporée dans une membrane contient aussi des sous-unités e (bleu foncé), f (rouge foncé) et Voa1p (rouge-orange).
Les ATPases de type V (V-ATPases) sont des complexes protéiques incorporés dans une membrane, qui agissent en tant que pompes à protons, mues par l’hydrolyse de l’ATP. Les V-ATPases sont une source primaire d’acidification des organelles cellulaires chez tous les eucaryotes, les rendant essentielles pour beaucoup de processus cellulaires. L’activité enzymatique peut être modulée par le désassemblage du complexe à la fois soumis à régulation et réversible, et plusieurs sous-unités de V-ATPase de mammifères arborent de multiples isoformes, localisées de manière différentielle. Bien que les propriétés biochimiques des différentes isoformes soient actuellement inconnues, les mutations identifiées dans des sous-unités spécifiques d’isoformes ont été associées à des pathologies variées, faisant des V-ATPAses des cibles potentielles pour l’action des médicaments. C’est chez Saccharomyces cerevisiaeque la structure et l’activité des V-ATPases ont été le mieux caractérisées, où des structures récentes ont révélé des détails de dynamique enzymatique, du site de translocation des protons, et de changements conformationnels associés à un désassemblage réglé et une autoinhibition. Thamiya Vasanthakumar, John L. Rubinstein, dans Trends in Biochemical Sciences, publication en ligne en avant-première, 28 janvier 2020
Source iconographique, légendaire et rédactionnelle : Science Direct / Traduction et adaptation : NZ
