#cell #carcinomemétastatique #environnementcellulaire #transcriptome Analyse transcriptomique sur cellule unique d’écosystèmes tumoraux métastatiques de la tête et du cou
Publié le 06 décembre 2017 par Tartempion77
@NZarjevski
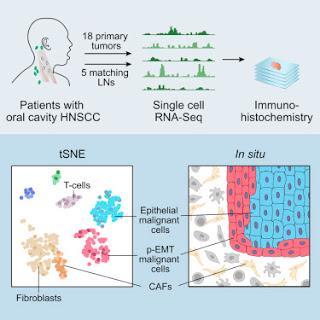
18 primary tumors = 18 tumeurs primaires
5 matching LNs = 5 ganglions lymphatiques correspondants
Patients with oral cavity HNSCC = Patients atteints de carcinomes à cellules squameuses de la tête et du cou
Single cell RNA-sEQ = Séquençage d'ARN au niveau d'une cellule unique
Immuno-histochemistry = Immunohistochimie
tSNE = visualisation spatiale en deux dimension par ladite technique (réduction de dimension)
Epithelial malignant cells = Cellules malignes épithéliales
p-EMT malignant cells = Cellules malignes de transition épithélio-mésenchymateuse partielle
CAFs = Fibroblastes associés au cancer
Les diverses cellules malignes dans les tumeurs stromales et immunitaires influent sur la croissance, la métastatisation et sur la réponse aux traitements. Nous avons profilé les transcriptomes d’environ 6 000 cellules uniques provenant de patients atteints de carcinomes à cellules squameuses de la tête et du cou (CCSTC), incluant cinq paires homologues de tumeurs primaires et de métastases des ganglions lymphatiques. Les cellules stromales et immunes présentaient des programmes d’expression significatifs dans l’ensemble des patients. En revanche, les cellules malignes varient au sein d’une même tumeur et entre les différentes tumeurs pour ce qui est de leur expression de signatures liées au cycles cellulaires, au stress, à l’hypoxie; et pour ce qui est la différentiation épithéliale et de la transition épithélio-mésenchymateuse partielle (p-EMT). Les cellules exprimant le programme p-EMT se localisent, sur le plan spatial, sur le bord d’attaque des tumeurs primaires. En intégrant les transcriptomes à cellule unique avec les profils d’expression en masse pour des centaines de tumeurs, nous affinons les sous-types de CCSTC par type de malignité, composition des cellules stromales, et profil p-EMT comme prédicteur indépendant de métastatisation des ganglions, de leur grade et des caractéristiques pathologiques indésirables. Nos résultats fournissent un éclairage en termes d’écosystème CCSTC et définissent les interactions stromales et le programme p-EMT associé à la métastatisation. Sidharth V. Puram, et al, dans Cell, publication en ligne en avant-première, 30 novembre 2017
Source iconographique, légendaire et rédactionnelle : Science Direct / Traduction et adaptation : NZ

