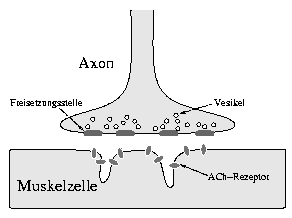
Lors d'une Myasthénie Grave, la transmission du signal entre axone (Axon) et cellules musculaires (Mudkrlerllr) ne se fait plus, entraînant une paralysie.
Source iconographique: https://de.wikipedia.org/wiki/Myasthenia_gravis#/media/File:MuskelEndplatte.png
Nous avons effectué une étude multicentrique de phase 3, randomisée, en double-aveugle (REGAIN) dans 76 hôpitaux et cliniques spécialisées dans 17 pays situés en Amérique du Nord, Amérique Latine, Europe, et en Asie. Les patients éligibles étaient âgés d’au moins 18 ans, atteints d’une myasthénie grave présentant un score de 6 ou plus en termes de MG-ADL*, (…), une pathologie classée II-IV selon les critères de la Fondation Myasthenia Gravis des États – Unis d’Amérique (MGFA), vaccinés contre Neisseria meningitides, et ayant reçu au moins deux thérapies immunosuppressives, des immunoglobulines en chronique administrées par voie intraveineuse ou subi un échange plasmatique pendant 12 mois sans contrôle des symptômes. Les patients présentant un historique de thymome ou de néoplasies thymiques, de thymectomie dans les 12 mois précédant le dépistage, ou ayant reçu des immunoglobulines par voie intraveineuse ou subi un échange plasmatique dans les 4 semaines avant la randomisation, ou reçu du rituximab dans les 6 mois avant le dépistage, étaient exclus de l’étude. Nous avons réparti les participants (1:1) de manière aléatoire pour recevoir l’eculizumab par voie intraveineuse ou le placebo correspondant, également par voie intraveineuse pendant 26 semaines. L’eculizumab était administré à raison de 900 mg au jour 1 et aux semaines 1, 2, 3 ; et 1 200 mg à la semaine 4 ; et 1 200 mg adminstré une fois toutes les deux semaines par la suite, comme traitement de maintien. La randomisation était effectuée de manière centralisée par système de réponse interactive, vocale ou internet (…). À chaque fois que cela était possible, les patients étaient maintenus sous traitement existant contre la myasthénie grave ; le traitement de secours étant autorisé à l’appréciation du médecin. Ni les patients, ni les investigateurs, ni le personnel, ni les accesseurs chargés de l’évaluation des résultats n’avaient accès au tableau de randomisation. Le critère principal d’efficacité était le changement du score MG-ADL total, de la ligne de base à la semaine 26, mesuré à l’aide de l’analyse de covariance ANCOVA. La population d’évaluation de l’efficacité était définie comme l’ensemble de tous les patients répartis de manière aléatoire aux groupes de traitement qui avaient reçu au moins une dose de médicament à l’étude, qui présentaient une évaluation valable de leur ligne de base, et au moins une évaluation du score MG-ADL au-dessus de la ligne de base. Toutes les analyses d’efficacité incluaient tous les patients répartis de manière aléatoire qui avaient reçu l’eculizumab ou le placebo. (…).
Entre le 30 avril 2014 et le 19 février 2016, nous avons randomisé et soumis à traitement 125 patients, 62 d’entre eux ont reçu l’eculizumab, et 63 ont reçu le placebo. L’analyse principale n’a montré aucune différence entre eculizumab et placebo (rang moyen par la méthodes des moindres carrés 56.6 [SEM 4.5] versus 68.3 [4.5] ; différence entre les traitements évaluée sur la base du rang atteint -11.7, Intervalle de Confiance [IC] 95% de -24.3 à 0.96 ; p=0.0698). Aucun décès ni cas d’infection au méningocoque ne sont survenus au cours de l’étude. Les événements indésirables les plus communément rencontrés entre les groupes étaient migraine et infection du tractus respiratoire supérieur (dix cas [16%] survenus pour chacun des deux événements survenus dans le groupe eculizumab et 12 cas [19%] survenus pour chacun des deux événements survenus dans le groupe placebo). Les exacerbations de myasthénie grave ont été rapportées chez six patients (10%) du groupe eculizumab et 15 patients (24%) dans le groupe placebo. Six patients (10%) dans le groupe eculizumab et 12 patients (19%) dans le groupe placebo ont nécessité que leur soit administrée une thérapie de secours.
Le changement en score MG-ADL n’était pas statistiquement significatif entre eculizumab et placebo, selon l’analyse effectuée selon le rang le plus bas. L’utilisation de l’analyse selon le rang le plus bas s’est révélée être un facteur d’approche limitant dans cette étude, du fait que l’analyse secondaire de l’étude n’était pas cohérente avec le résultat d’analyse principale ; de futures recherches relatives au rôle du système de complément s’avèrent donc nécessaires. Prof James F Moward Jr, MD, et al, dans The Lancet Neurology, publication en ligne en avant-première, 20 octobre 2017
Financement : Alexion Pharmaceuticals
Source : The Lancet Online / Traduction et adaptation : NZ
*Qualité de Vie associée à la Myasthénie Grave
