La Cryo-EM de la dynéine cytoplasmique humaine révèle le mécanisme sous-jacent de son auto-inhibition et de son activation.
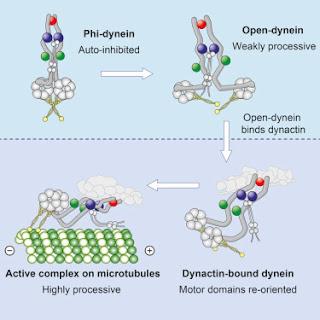
La dynéine-1 cytoplasmique se lie à la dynactine et à la protéine cargo adaptatrice pour former une machine de transport capable de se déplacer sur de longues distances dans un mouvement propulseur le long des microtubules. Cependant, il reste peu clair pourquoi la dynéine-1 se meut difficilement par elle – même ou comment elle est activée par la dynactine. Ici, nous présentons la structure complète révélée par cryo-microscopie électronique (cryo-ME) du complexe dynéine-1 humaine en état inhibé connu sous le nom de particule phi. Nous révélons la structure tridimensionnelle de la queue de la dynéine liant la protéine cargo et montrons comment l’auto-dimérisation des domaines moteurs les verrouille sous une conformation avec une faible affinité pour les microtubules. En perturbant la dimérisation motrice à l’aide d’une mutagénèse des structures, on conduit la dynéine-1 à se présenter sous forme ouverte avec une affinité augmentée pour les microtubules et la dynactine à la fois. Nous trouvons que la forme ouverte est aussi inhibée pour le mouvement et que la dynactine soulage ce stress en réorientant les domaines moteurs afin d’interagir correctement avec les microtubules. Notre modèle explique comment la liaison de la dynactine à la queue de la dynéine-1 stimule directement son activité motrice. Kai Zhang, et al, dans Cell, publication en ligne en avant-première, 15 juin 2017Source inconographique, légendaire et rédactionnelle : Science Direct / Traduction et adaptation : NZ
