Cette étude française, menée chez la souris, va aider les scientifiques et les médecins à comprendre comment le tamoxifène réduit l'apport alimentaire, empêche l'accumulation de graisse, la résistance à l'insuline et les dépôts de foie gras. Des travaux présentés dans l'American Journal of Pathology qui suggèrent que les effets métaboliques du tamoxifène soient reconsidérés chez les femmes, selon leur état ménopausique. Des données qui ouvrent également de nouvelles perspectives pour le traitement de l'obésité.
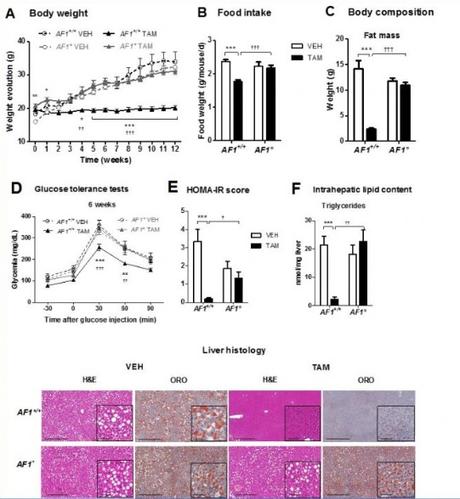
Les chercheurs de l'Institut des Maladies Métaboliques et Cardiovasculaires, Université de Toulouse (France) ont nourri des souris dont les ovaires ont été enlevés avec un régime riche en matières grasses et les ont traitées avec du tamoxifène ou un placebo pendant 12 semaines. Les chercheurs constatent que le tamoxifène a empêché le gain de poids via une réduction significative de l'apport alimentaire vs témoins. De plus, les souris traitées par tamoxifène s'avèrent moins susceptibles de développer une intolérance au glucose, une résistance à l'insuline, ainsi que des dépôts de graisse dans le foie.
Au centre de ces processus, le récepteur des œstrogènes α (ERα ), identifié comme un régulateur clé de l'énergie et de l'homéostasie du glucose et, par conséquent, considéré comme une cible prometteuse pour développer de nouvelles stratégies thérapeutiques contre les troubles métaboliques liés à l'obésité. Les chercheurs savaient que ERα exerce ses effets à travers 2 fonctions d'activation appelées ERα-AF1 et ERα-AF2, directement impliquées dans la régulation transcriptionnelle de l'expression des gènes. Le tamoxifène agit comme un agoniste ERα-AF1 ou un antagoniste ERα-AF2 selon ses cibles tissulaires / organiques. Pour mieux comprendre les mécanismes moléculaires sous-jacents aux effets métaboliques du tamoxifène, les scientifiques ont traité des souris génétiquement élevées pour être déficientes soit pour l'ensemble ER-α soit simplement pour la fonction ERα-AF1, par tamoxifène ou placebo, puis ont comparé les résultats à des souris de type sauvage ayant subi le même traitement. Toutes les souris ont reçu un régime riche en matières grasses.
Le tamoxifène perd tout effet chez la souris déficiente en ERα-AF1. Cela suggère que l'activation d'ERα-AF1 par le tamoxifène est suffisante à permettre ces effets protecteurs métaboliques in vivo. De plus, l'activation sélective d'ERα-AF1 par le tamoxifène apparait réguler également la plupart des gènes métaboliques hépatiques.
Ces résultats confirment les effets métaboliques du tamoxifène, ou ceux d'autres modulateurs sélectifs de l'ERa, qui doivent " être prudemment reconsidérés chez les femmes, selon leur état ménopausique " , écrivent les chercheurs dans leur communiqué. Ils ouvrent également de nouvelles perspectives pour le traitement de l'obésité.
The American Journal of Pathology May, 2017 DOI: 10.1016/j.ajpath.2017.02.013 Selective Activation of Estrogen Receptor α Activation Function-1 Is Sufficient to Prevent Obesity, Steatosis, and Insulin Resistance in Mouse


