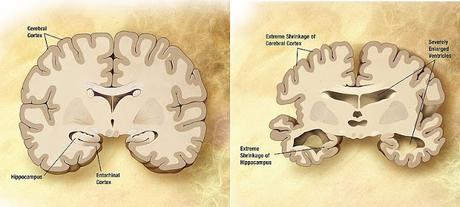
Cerveau sain (à gauche) versus cerveau atteint de la maladie d'Alzheimer (à droite)
Extreme shrinkage of the Cerebral Cortex = Rétrécissement Extrème du Cortex Cérébral
Severely Enlarged Ventricules = Ventricules Très Agrandis
Extreme shrinkage of the Hippocampus = Rétrécissement Extrême de l'Hippocampe
Source iconographique et légendaire: Wikipedia
Tous les participants étaient en consultation dans le cadre de l’Étude du Vieillissement de la Clinique Mayo (Mayo Clinic Study of Aging dans le texte), étude basée sur la population faisant usage d’archives médicales et de bases de données pour la comptabilisation de toutes les personnes âgées de 50 ans à 89 ans domiciliées dans le canton d’Olmsted, Minnesota, aux États-Unis d’Amérique. Les participants potentiels étaient sélectionnés de manière aléatoire, stratifiés selon l’âge et le sexe et étaient invités à participer aux évaluations cognitives ; les sujets sans contre-indications médicales étaient invités à participer aux études d’imagerie du cerveau. Tout participant qui était défini cliniquement comme exempt de trouble cognitif et qui avait subi un examen d’imagerie multimodale entre le 11 octobre 2006 et le 5 octobre 2016, était inclus dans la présente étude. Les participants étaient classés de la manière suivante: dépôts amyloïdes normaux (A-) ou anormaux (A+) selon l’imagerie par tomographie d’émission de positions (TEP) amyloïde, protéine tau (tauopathie) normale (T-) ou anormale (T+) à l’aide de la TEP tau, neurodégénérescence ou lésions neuronales normale(s) (N-) ou anormale(s) (N+) par mesure de l’épaisseur corticale par IRM. Nous avons utilisé des valeurs de référence de taux de captation (SUVR pour Standard Uptake Value Ratio dans le texte) de 1.42 (19ème centile) pour la TEP amyloïde, de 1.23 de SUVR pour la TEP tau, et de 2.67 mm pour l’épaisseur corticale mesurée par IRM. Les prévalences spécifiques de l’âge et spécifique du sexe étaient déterminées à l’aide de modèles multimodaux combinant les données de 435 sujets chez lesquels des mesures de TEP amyloïde, TEP tau et IRM étaient disponibles, et 1 113 sujets ayant été soumis à des TEP amyloïde, IRM, mais pas à une TEP tau.
Le nombre de participants dans chaque groupe de profilage étaient de 165 A-T-N-, 35 A-T-N+, 19 A-T+N+, 44 A+T-N-, 25 A+T+N- et 49 A+T+N+. La moyenne d'âge était différente selon les groupes ATN (p<0.0001), s’échelonnant entre des médianes de 58 ans (Intervalle Interquartile [IQR] 55-64) chez les A-T-N- et de 57 ans (54-64) chez les A-T+N- et des médianes de 80 ans (75-84) chez les A+T-N+ et de 79 ans (73-87) chez les A+T-N+ et 79 ans (73-87) chez les A+T+N+. Le nombre de porteurs du variant à haut risque APOE-ɛ4 du gène APOE était différent selon le groupe ATN (p=0.04) ; le sujets présentant le variant APOE-ɛ4 se retrouvant deux fois plus fréquemment dans chaque groupe A+ versus le groupe correpondant A-. Le volume d’hyperintensité de la substance blanche (p<0.0001) et la performance cognitive (p<0.0001) a également différé selon les groupes ATN.La TEP tau ainsi que les biomarqueurs de neurodégénérescence étaient discordants chez la plupart des sujets pouvant classés comme stade 2 ou stade 3 de maladie d’Alzheimer préclinique (A+T+N-, A+T-N+, et A+T+N+ ; 86% à l’âge de 65 ans et 51% à l’âge de 80 ans) ou présentant une suspicion de pathophysiologie non-Alzheimer (A-T+N-, A-T-N+, et A-T+N+ ; 92% à l’âge de 65 ans et 78% à l’âge de 80 ans). À partir de l’âge de 50 ans, la prévalence A-T-N- était en diminution et les prévalences A+T+N+ et A-T+N+ étaient en augmentation. À la fois chez les hommes et chez les femmes, c’est le profil A-T-N- qui présentait la plus forte prévalence, jusqu’à l’âge de 70 ans. Après l’âge de 80 ans environ, c’est le profil A+T+N+ qui présentait la plus forte prévalence. Arrivés à l’âge de 85 ans, plus de 90% des hommes et des femmes présentaient des anomalies d’un ou plusieurs biomarqueurs.
Les biomarqueurs de dépôts fibrillaires tau peuvent être inclus avec ceux de la protéine β-amyloïde et de la neurodégénérescence ou des lésions neuronales ; afin de mieux caractériser les profils pathologiques hétérogènes dans la population. À la fois les profils pathologiques dépendant des dépôts amyloïdes et ne dépendant pas des dépôts amyloïdes peuvent être indentifiés dans cette population restée exempte de troubles cognitifs. Prof Clifford R Jack Jr, MD, et al, dans The Lancet Neurology, publication en ligne en avant-première, 26 avril 2017
Financement : Institut National de Recherche sur le Vieillissement (dépendant du l’Institut National de la Santé des États-Unis), Famille Alexander, Bourse de Recherche Professorale sur la Maladie d’Alzheimer, la Clinique Mayo, Fondation GHR
Source : The Lancet Online / Traduction et adaptation : NZ
