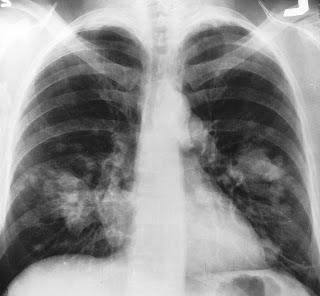
Radiographie du thorax vu de face montrant un cancer probable du poumon (taches claires à droite de chacun des poumons).
Source iconographique: https://fr.wikipedia.org/wiki/Cancer_du_poumon#/media/File:X-ray_chest_cancer.jpg
Dans cette cohorte d’expansion de dose d’un essai multicentrique ouvert de phase 1, des patients atteints de CBNPC en progression ou métastatique résistant au platine ou récidivant ont été recrutés dans 58 centres de traitement du cancer et hôpitaux universitaires aux USA. Les patients éligibles avaient un CBNPC de stade IIIB ou IV confirmé ; leur pathologie présentait une histologie squameuse ou non squameuse et était mesurable selon les Critères d’Évaluation de la Réponse des Tumeurs Solides version 1.1 (RECIST v1.1), ces patients pouvaient en outre présenter une biopsie de la tumeur ou un échantillon de la tumeur prélevé pour étude des biomarqueurs, et ils présentaient un statut de Performance ECOG de 0 ou 1, parmi d’autres critères. La sélection des patients n'était pas basée sur l’expression de PD-L1 ou l’expression d’autres biomarqueurs, mutation EGFR ou KRAS ou status de translocation ALKinclus. Les patients ont reçu avelumab en monothérapie par perfusion à raison de 10 mg/kg toutes les deux semaines jusqu’à progression de la maladie ou toxicité. L’objectif principal de l’étude était d’évaluer l’innocuité et la tolérabilité. (…) Le recrutement de sujets dans cette cohorte est toujours en cours.
Entre le 10 septembre 2013 et le 24 juin 2014, 184 patients ont été recrutés et ont commencé le traitement avec avelumab. La durée médiane de suivi était de 8.8 mois (Intervalle Interquartile [IQR] 7.2-11.9). Les événements indésirables liés au traitement - quel qu’en soit le grade - les plus communément relevés étaient fatigue (46 [25%] patients sur 184), réaction liée la perfusion (38 [21%]), et nausée (23 [13%]). Des événements indésirables de grade 3 ou plus liés au traitement sont survenus chez 23 (13%) patients sur 184 ; les plus fréquemment relevés (survenant chez plus de deux patients) étant réaction à la perfusion (quatre [2%] patients) et niveaux augmentés de lipase (trois [2%]). 16 (9%) patients sur 184 ont présenté des événements désirables graves liés au traitement avec avelumab, dont réaction à la perfusion (chez quatre [2%] patients) et dyspnée (chez deux patients [1%]) survenant chez plus d’un patient. Des événements indésirables graves sont survenus, de manière générale, chez 80 (44%) patients sur 184. Ceux survenant chez plus de cinq patients (≥%) étaient dyspnée (dix patients [5%]), pneumonie (neuf [5%]), et maladie pulmonaire obstructive chronique (six [3%]). Des événements liés à l’immunité sont survenus chez 22 patients (12%). Sur 184 patients, 22 (12% [Intervalle de Confiance -IC- 95% 8-18]) ont obtenu une réponse objective, incluant une réponse complète et 21 réponses partielles. 70 (38%) patients avaient une pathologie stable. Dans l’ensemble, 92 (50%) patients sur 184 sont parvenus au contrôle de leur pathologie (ils présentaient une réponse confirmée ou une stabilité de leur maladie au meilleur de leur réponse globale au traitement). Un patient est décédé, on a initialement imputé ce décès à une pneumonie radique de grade 5 survenue au cours de l’essai ; cependant, cet événement indésirable a par la suite été requalifié en pneumonie de grade 3, et le décès du patient imputé à une progression de la maladie.
L’avelumab a montré un profil d’innocuité acceptable et une activité antitumorale chez des patients atteints de CBNPC progressant ou résistant au traitement, justifiant ce faisant de futures études pour mieux caractériser l’activité d’avelumab dans ce contexte. Dr James L Gulley, dans The Lancet Oncology, publication en ligne en avant-première, 31 mars 2017
Financement : Merck KGaA and Pfizer
Source: The Lancet Online / Traduction et adaptation: NZ
