 Bon, la découverte est réalisée ici sur la mouche, mais le principe pourrait être identique chez l'Homme : il s'agit de la découverte d'une molécule envoyée par les cellules adipeuses au cerveau qui lui dit " ça suffit, vous avez suffisamment mangé " et inhibe ainsi l'alimentation. Ces travaux, présentés dans la revue PLoS Biology, confirment que le tissu adipeux envoie des signaux moléculaires au cerveau pour réguler le comportement alimentaire. Ils suggèrent aussi ce mécanisme de suppression de l'appétit, très probablement répliqué chez l'Homme, comme une cible prometteuse pour de nouveaux traitements contre l'hyperphagie et l'obésité.
Bon, la découverte est réalisée ici sur la mouche, mais le principe pourrait être identique chez l'Homme : il s'agit de la découverte d'une molécule envoyée par les cellules adipeuses au cerveau qui lui dit " ça suffit, vous avez suffisamment mangé " et inhibe ainsi l'alimentation. Ces travaux, présentés dans la revue PLoS Biology, confirment que le tissu adipeux envoie des signaux moléculaires au cerveau pour réguler le comportement alimentaire. Ils suggèrent aussi ce mécanisme de suppression de l'appétit, très probablement répliqué chez l'Homme, comme une cible prometteuse pour de nouveaux traitements contre l'hyperphagie et l'obésité.
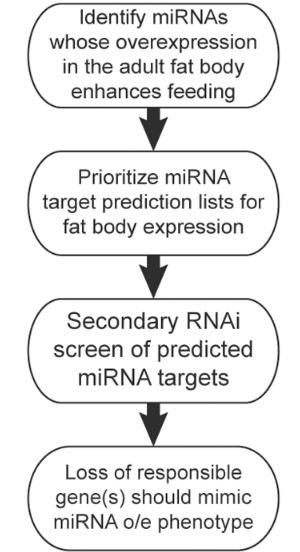
A la recherche d'un signal inhibiteur : les chercheurs se concentrent ici sur de courts ARN non codants ou microARNs (voir schéma ci-contre), qui sont des inhibiteurs connus de l'expression des gènes. Ils ont d'abord recherché les microARNs qui surexprimés dans le tissu adipeux affectent le comportement alimentaire, puis, dans un second temps les cibles géniques de ces microARNs. C'est ainsi que les chercheurs identifient " miR-iab-4 " , un miARN qui augmente l'alimentation de plus de 27%, et identifient son gène cible violet ( " Purple " ).
Violet inhibe ou stoppe l'alimentation . Purple est connu pour être l'une des 2 enzymes qui constituent une molécule appelée PTP, libérée par les corps gras et circulante dans le cerveau (de la mouche). Une troisième enzyme convertit PTP en un cofacteur enzymatique bien connu, appelé tetrahydrobiopterine (BH4). BH4 est en effet nécessaire dans les neurones qui produisent NPF, un neuropeptide qui régule l'alimentation. Bref, " perdre " Violet ou BH4 dans les neurones, conduit à une libération accrue de FNP et à une alimentation accrue. Inversement, l'augmentation de BH4 dans les neurones réduit la libération des FNP et donc l'alimentation. Enfin, l'alimentation (des mouches) avec un régime faible en calories réduit l'expression des enzymes qui contrôlent la production de BH4 et conduit à une alimentation accrue.
Cibler le signal moléculaire adressé par le tissu adipeux au cerveau : ces résultats suggèrent que le BH4 joue un rôle clé dans la suppression de l'appétit chez les mouches et que le PTP libéré par les corps gras fournit un signal au cerveau indiquant que les réserves d'énergie sont suffisantes et que l'alimentation peut s'arrêter. Des résultats qui ne s'appliquent qu'aux mouches mais qui suggèrent un mécanisme de suppression de l'appétit connexe chez l'homme.
March 28, 2017 DOI: 10.1371/journal.pbio.2000532 A fat-derived metabolite regulates a peptidergic feeding circuit in Drosophila


