L’agriculture cellulaire permet de reproduire des protéines animales sans recourir à l’élevage. Une alternative pour répondre aux défis du secteur agricole et aux besoins alimentaires croissants liés à la démographie et à l’urbanisation.
La population mondiale grandit inexorablement. Selon les Nations Unies, la planète comptera 9,7 milliards d’habitants en 2050. Et ce sont les villes qui accueilleront la majorité de la population. Si, en 1960, les citadins représentaient 34 % de la population mondiale, ils atteignaient 54 % en 2014. Et on s’attend à ce que la population urbaine augmente de 2% par an en moyenne d’ici 2030. Ces 2 milliards de bouches supplémentaires à nourrir et cette concentration vers les zones urbaines invitent à repenser l’ensemble de la chaîne de production et de distribution alimentaire.
Les enjeux environnementaux sont également de taille. D’après l’ONG Global Footprint Network, si nous maintenons notre rythme de croissance actuel, il faudrait 2 planètes pour subvenir à nos besoins en ressources naturelles d’ici 2030.
L’agriculture, premier secteur impacté, doit donc produire davantage, dans un contexte de restriction des réserves (épuisement des sols et des nappes phréatiques). Le bât blesse particulièrement du côté de la production animale. À l’échelle mondiale, 18% des émissions de CO2 proviennent de la production de viande seule. Et il faut aujourd’hui 1.670 litres d’eau pour produire 500 grammes de viande de bœuf. En parallèle, la consommation de viande croît à un rythme effréné. Dans les pays en développement, là où l’augmentation de la population est la plus vigoureuse, la consommation de viande a augmenté de 5 à 6 % par an au cours des dernières décennies, celles du lait et des produits laitiers de 4 % environ.
La pression exercée sur la production animale donne naissance à une agriculture industrielle intensive, polluante. Aux États-Unis, entre 1997 et 2012, la taille des élevages laitiers a doublé tandis que les élevages allaitants (élevages destinés à la production de viande) sont passés de 3.800 têtes en moyenne à plus de 4.000.

Les défis de l'agriculture, tirée de l'étude "AgTech: Will technology feed and save us?" par L'Atelier BNP Paribas
Pour tenter de relever ces défis, plusieurs solutions émergent. L’AgTech avec l’agriculture pilotée par la donnée permet une optimisation des tâches pour les agriculteurs. L’agriculture urbaine, verticale, en intérieur ou en extérieur, ouvre également la voie pour répondre aux besoins d’approvisionnement des smart cities.
Une alternative de rupture se fait aujourd’hui entendre, notamment en Californie, terre agricole et d’innovations : l’agriculture cellulaire. Grâce aux avancées en matière d’ingénierie tissulaire et de biologie de synthèse, cette forme d’agriculture entend produire de la viande, des œufs, des produits laitiers mais aussi du cuir, et potentiellement bien d’autres produits dérivés d’animaux, en ayant recours à la culture cellulaire et non à l’élevage animal traditionnel.
Deux types de produits peuvent être réalisés par le biais de ce type d’agriculture en laboratoire : des produits non-cellulaires (protéines et composés organiques tels que la vanilline, la gélatine ou encore l’ovalbumine et la caséine) et des produits cellulaires (tels que la viande, les abats ou le cuir).
Le produit final, qu’il soit issu d’une culture classique végétale ou animale ou d’une culture en laboratoire, est le même. Seul le procédé de production change, précise New Harvest, une ONG qui finance des projets dans le domaine et rassemble une communauté de scientifiques et d’intéressés pour contribuer à vulgariser le concept.
L’insuline, premier acide aminé produit dans des boîtes de pétri
Les produits non-cellulaires sont créés en boîtes de pétri (boîte pour la mise en culture de micro-organismes) grâce à l’intervention de microbes (levures ou bactéries), dans lesquels on insère le gène responsable de la création de la protéine que l’on souhaite générer. Cette technique n’a rien de nouveau. L’insuline, découverte en 1889, était historiquement prélevée à partir du pancréas de porcs et de bœufs. Une pratique difficilement industrialisable. En 1978, trois scientifiques, Arthur Riggs, Keiichi Itakura et Herbert Boyer introduisaient pour la première fois le gène porteur de l’insuline humaine au sein d’une bactérie, de sorte que celle-ci puisse reproduire à l’identique l’insuline générée par les humains. Trente ans plus tard, la grande majorité de l’insuline utilisée dans le monde est produite par des bactéries et des levures.
Un scénario similaire est à observer dans le fromage. Au coeur de sa fabrication siège la présure, un coagulant naturel, à l’origine extrait de la caillette des veaux (le quatrième estomac des jeunes ruminants). Aujourd’hui, la présure d’origine animale n’est plus le seul coagulant utilisé pour la réalisation des fromages, l’industrie agroalimentaire a également recours à des ferments lactiques, par exemple. Et depuis 1990, (date à laquelle la FDA - Food and Drug Administration - a validé le procédé), bon nombre de fromages américains sont réalisés grâce à de la présure produite par des levures et des bactéries élevées en laboratoire.
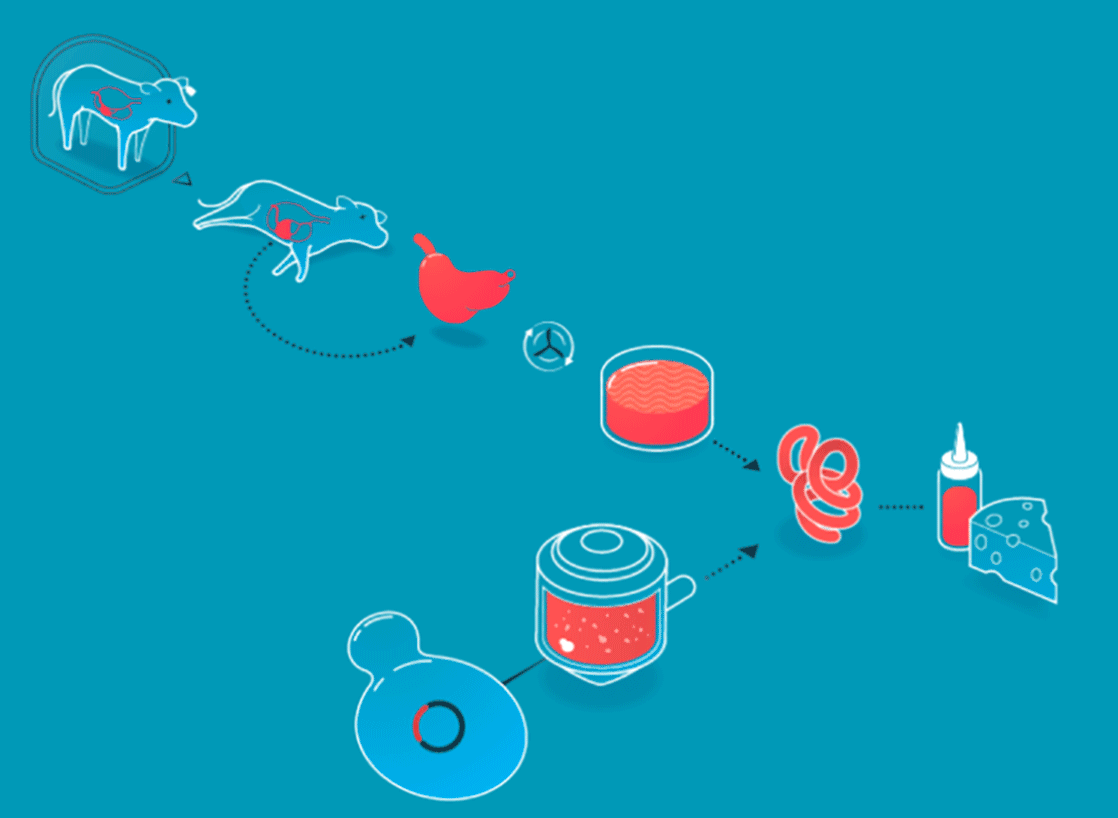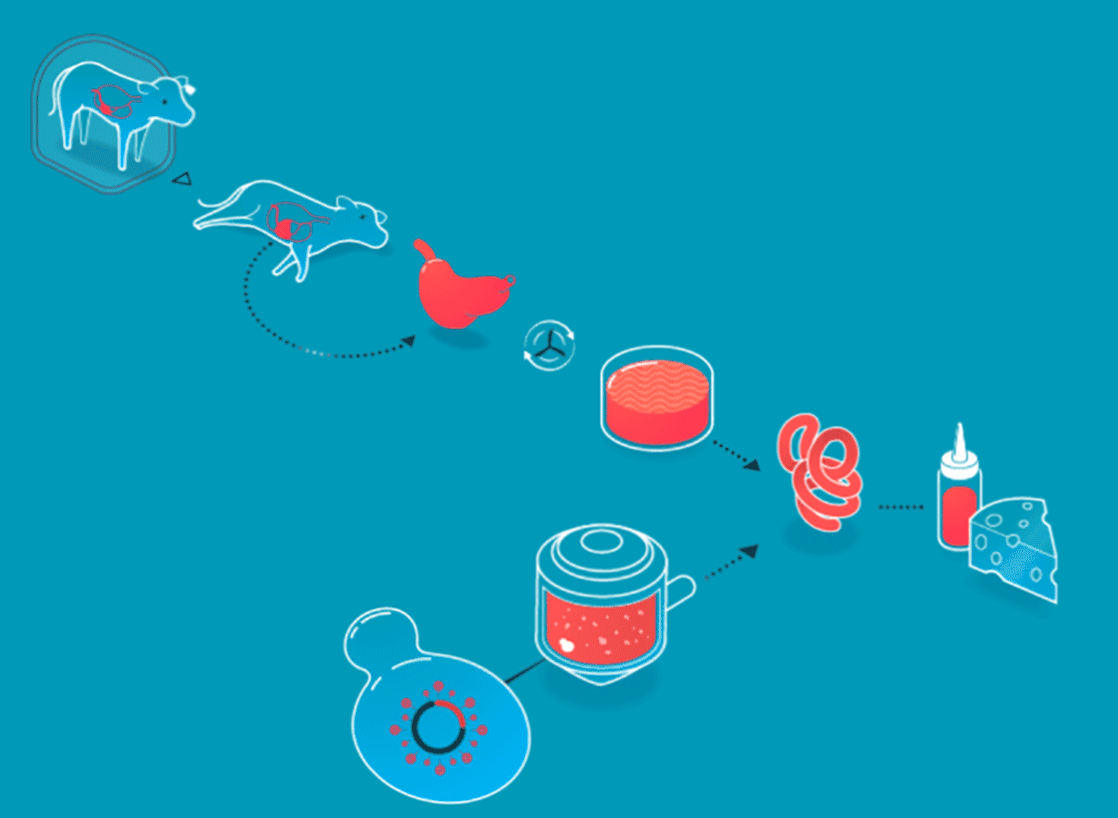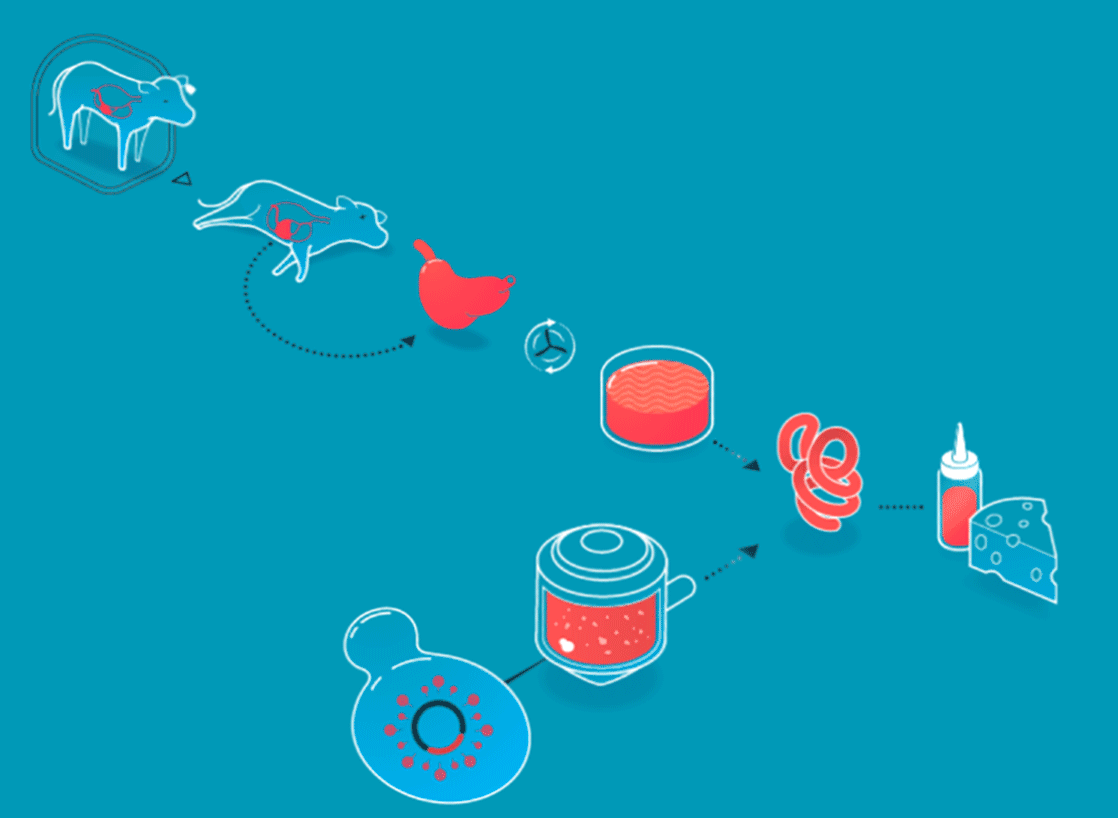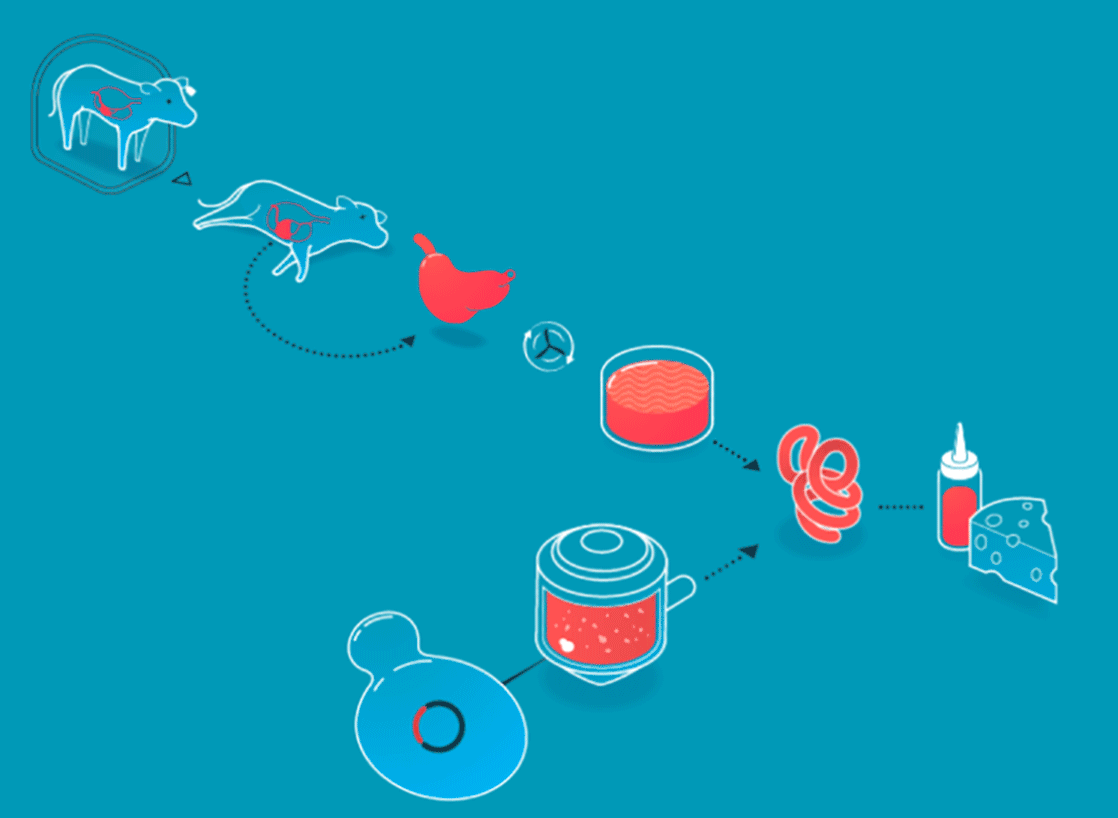
Les procédés de l'agriculture cellulaire expliqués par New Harvest
Le premier burger « in vitro »
Si ces techniques ne datent pas d’hier, elles sont aujourd’hui amplifiées par les dernières avancées en matière de biotechnologies. En 2005, les premières recherches scientifiques ont été entamées aux Pays-Bas et en 2009, la toute première viande de laboratoire a été créée. En 2013, Mark Post, un chercheur néerlandais de l’Université de Maastricht, faisait sensation en révélant aux yeux du monde l’existence du « premier burger in vitro », un projet sur lequel une poignée de scientifiques a travaillé pendant deux ans, pour un coût total de ... 350.000 dollars !
Depuis peu, c’est au tour des start-ups de s’emparer de ce sujet d’actualité. L’Atelier a notamment identifié vingt start-ups américaines spécialisées dans l’agriculture cellulaire. Au cours des cinq dernières années, elles ont attiré pas moins de 477,2 millions de dollars. Bill Gates a ainsi investi dans les start-ups Impossible Foods et Beyond Meat. Cette dernière a également été soutenue par les deux cofondateurs de Twitter. Deux approches se dessinent parmi ces jeunes pousses : celles qui se lancent dans la culture de viande, œufs, produits laitiers et fromages à partir de cellules souches animales et celles qui puisent protéines et autres éléments constitutifs d’un produit dans le règne végétal afin d’en reconstituer l’aspect, le goût et les propriétés nutritionnelles.
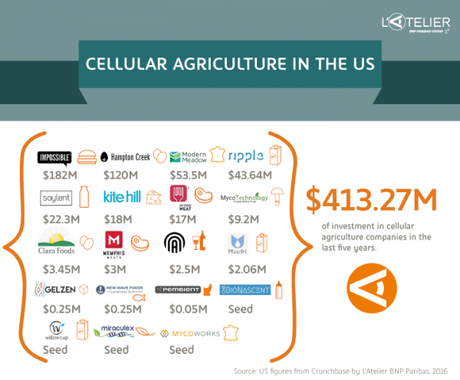
« La viande en culture »
Des jeunes pousses se lancent dans le développement de viande à partir de cellules souches animales, technique désignée en anglais par le terme de « cultured meat » (viande issue de culture en laboratoire). C’est le cas de Memphis Meat, une start-up située à San Francisco. Elle a récemment levé 3 millions de dollars pour produire de la viande de bœuf et de porc sans recours à l’élevage traditionnel, mais à partir de véritables cellules de vaches et de porcs. Memphis Meat, rencontrée lors de la conférence New Harvest, entend distribuer ses produits dès 2021 dans les restaurants.
« Il faut entre quatorze et vingt-et-un jours aux cellules pour mûrir au sein d’un bioréacteur. nous explique David de Memphis Meat. Contrairement à ce qu’on pourrait penser, il ne s’agit pas de viande grandie en laboratoire, avec toutes les connotations négatives que cela peut générer. Il est plus juste de voir cette nouvelle manière de produire comme une technique de brasserie, non pas pour produire de la bière mais bien de la viande ! ». Produire 450 grammes de viande de bœuf coûterait aujourd’hui à la start-up 18.000 dollars. « Nous essayons d’industrialiser nos procédés pour réduire nos coûts », confiait Uma Valeti, cofondateur de Memphis Meat, au magazine Fortune en mai dernier.

Le Professeur Mark Post tient dans ses mains le premier burger in vitro (crédits photo : David Parry/AFP/Getty Images)
À l’inverse, Impossible Foods, fondée en 2011 et qui a levé un total de 182 millions de dollars pour soutenir son expansion, propose un steak de bœuf haché entièrement réalisé à partir de plantes. Les ingénieurs d’Impossible Foods viennent en effet chercher l’ensemble des nutriments nécessaires à la constitution du steak dans des graines, des fèves et des légumes feuilles. Ils isolent en particulier une hémoprotéine à la structure très proche de l’hémoglobine (la leghémoglobine) dans les racines, ce qui leur permet de recréer la texture et la couleur du steak de bœuf que nous connaissons. Ils ajoutent ensuite acides aminés, vitamines et graisses afin de reconstituer les apports nutritionnels. Le burger d’Impossible Foods devrait être disponible cette année sur le marché américain. Le steak haché n’est qu’un début. La jeune pousse entend également s’attaquer à d’autres types de viandes, mais aussi au fromage.
Ces méthodes de production concernent aussi le poisson. New Wave Foods, une autre start-up californienne entreprend ainsi de produire du poisson à base de protéines végétales, en commençant avec… des crevettes de synthèse. Tout droit sortie d’Indie Bio, un accélérateur réputé, spécialisé dans les biotechnologies à San Francisco, elle aborde une approche similaire à Impossible Foods, en allant chercher dans les plantes les protéines nécessaires à la reconstitution des crevettes.
Mettre fin au paradoxe de l’œuf et de la poule !
La production de viande n‘est pas le seul fruit de l’agriculture cellulaire. Des acteurs du secteur se penchent sur un moyen de recréer des œufs en laboratoire. Avec 2.270 litres nécessaires à la production d’une douzaine d’œufs, « l’œuf sans la poule » est une piste prometteuse.
Clara foods a décidé de relever le défi. L’an passé, elle a levé 1,7 million de dollars pour continuer ses recherches sur le sujet. Comme l’a expliqué Arturo Elizondo, CEO de Clara Foods, à notre évènement consacré au futur de l’alimentation, en juin dernier, le marché du blanc d’œuf est en croissance. Aux États-Unis, il a atteint les huit milliards de dollars en 2015. La demande émane surtout de l’industrie agroalimentaire, intéressée par son potentiel.
Le blanc d’œuf étant constitué à 90% d’eau et 10% de protéine, il se prête parfaitement à la production in vitro. Qu’il soit employé pour ses propriétés d’émulsion, pour colorer ou encore pour faire le liant entre plusieurs ingrédients, il fait appel aux propriétés des protéines A, B ou C qu’il contient. Clara Foods se sert de la fermentation, un procédé ancestral et efficace, pour recréer ses quelques protéines au sein de boîtes de pétri.
En 2011, la start-up Hampton Creek a quant à elle commencé à produire de la mayonnaise sans œufs à l’aide de substituts végétaux comme le pois jaune canadien. Ils ont ensuite entamé sa commercialisation en Californie en 2013 sous le nom « Just Mayo ». Cette mayonnaise 2.0 est maintenant vendue dans tous les États-Unis. Grâce à des prix 10 % moins chers par rapport aux mayonnaises traditionnelles présentes sur le marché, ainsi qu’à des labels « sans cholestérol » ou « végétalien », les ventes ont augmenté de 350 % en 2015 !
Concevoir des produits laitiers sans recours à l’animal
Après la viande et les œufs, place au lait et ses produits dérivés. Les start-ups se multiplient. Une foule d’entre elles proposent une alternative au lait de vache. C’est notamment le cas de Ripple Foods, start-up à succès, qui développe du lait à partir d’un composé de protéines, vitamines et sucres naturels issues de pois jaunes, de canne à sucre et d’huile de tournesol. Selon les dires de Ripple Foods, leur lait serait jusqu’à 8 fois plus riche en protéines que le lait d’amande, il contiendrait également moitié moins de sucre que le lait de vache et aucun cholestérol.
Des projets, quoique plus rares se multiplient également autour de la culture de protéine de lait. Muufri, installée à San Francisco, a recours à la culture de levures pour créer du lait sans lactose. La start-up, qui a fait ses armes au sein de l’accélérateur Indie Bio, sélectionne une palette de protéines et d’acides gras pour reconstituer le goût, la texture et les apports nutritionnels du lait.
Le fromage, enfin, suscite également des vocations. Kite Hill, une jeune pousse de San Francisco est parvenue à lever 18 millions de dollars pour accompagner le développement de ses fromages conçus à partir d’amandes. Les produits de Kite Hill dont 4 types de fromages, 5 parfums de yaourts et 2 fromages à tartiner, sont d’ores et déjà disponibles dans les rayons de certains Whole Foods Market, la principale chaîne de produits biologiques aux États-Unis. Les fondateurs ambitionnent d’être accessibles au plus grand nombre et donc de commercialiser leurs produits dans d’autres chaînes de supermarchés.
Cheese made from #Almond?! Are you #nuts?! Well...we are going nuts to be more environment friendly! ;-) #foodtech pic.twitter.com/2h1c5JlOo0
— Atelier US (@atelier_us) June 3, 2016
Un but commun : une alternative écologique et transparente
Qu’elles choisissent de travailler sur la viande, les œufs ou les produits laitiers, de plus en plus de start-ups s’attaquent au sujet de l’agriculture cellulaire. Mais qu’y voient-elles de si prometteurs ? Le premier bénéfice réside dans son impact écologique. Il est en effet moindre comparé aux modes de production agricole actuels. La culture de viande in vitro consommerait 90 % d’eau, de sol et 50 % d’énergie en moins selon la start-up Memphis Meat. Rappelons que ce mouvement émerge précisément du constat de l’essoufflement de notre système agricole actuel, de ses conséquences sur l’environnement et de la pression qui pèse sur la production animale.
De plus, ces initiatives affichent une volonté commune : celle de produire en toute transparence. « L’agriculture cellulaire offre une opportunité de transparence extraordinaire tout en protégeant la propriété intellectuelle », commentait Arturo Elizondo, à l’occasion de la conférence New Harvest. Une intention partagée par les consommateurs puisqu’une étude conduite par Deloitte, le Food Marketing Institute et la Grocery Manufacturers Association révélait l’an passé que 51 % des consommateurs américains souhaitent disposer de labels clairs et précis sur l’origine des produits alimentaires. Ce qui implique par exemple que les produits à base d’OGM soient étiquetés en tant que tels. De plus, 47 % d’entre eux veulent disposer d’informations précises sur les ingrédients et la traçabilité des produits.
Et les exploitants agricoles dans tout ça ? « On devrait envisager l’agriculture cellulaire comme une opportunité d’aller discuter avec les agriculteurs. Il est crucial d’ouvrir le dialogue lors d’évènements agricoles pour montrer qu’il s’agit bien là d’une chance et d’une alternative à la production animale plutôt que d’une menace », explique Marianne Ellis, chercheuse à l’Université de Bath au Royaume Unis. Le Docteur Ellis collabore d'ailleurs, pour ses travaux de recherche sur la culture de viande in vitro, avec un exploitant anglais spécialisé dans l'élevage de porc et la production de charcuterie. « En Angleterre, l’agriculture fait partie de la vie rurale, elle façonne nos campagnes et ne peut disparaître. La viande in vitro pourrait être une cure de jouvence pour cette agriculture de terroir aujourd’hui en perdition », poursuit la chercheuse, qui envisage en effet l’agriculture cellulaire comme un moyen de revaloriser la viande traditionnelle sur les marchés agricoles.
De nombreux défis à relever
Pour l’heure, la nourriture issue de l’agriculture cellulaire demeure très chère à développer. Pas étonnant donc que la production à grande échelle soit l’obsession des start-ups du domaine. « Développer nos produits s’accompagne d’un coût conséquent. Le réduire fait partie de nos priorités. Si nous souhaitons impacter le plus grand nombre de personnes, il est essentiel que nous réussissions à industrialiser notre manière de procéder afin de faire baisser nos coûts », explique Ryan Pandya, co-fondateur et CEO de Muufri.

L'agriculture cellulaire fait face à des défis : la construction d'un cadre juridique, la capacité des start-ups à produire à grande échelle, les financements de projets, la confiance des consommateurs et l'exposition médiatique
Par ailleurs, le chantier du cadre juridique pour soutenir le développement de ces solutions est immense. La Commission européenne considère les produits de l’agriculture cellulaire comme « des aliments nouveaux » (en anglais « novel food »), c’est à dire des aliments ou des ingrédients dont la consommation était négligeable voire inexistante dans les pays de l'Union Européenne avant 1997. La mise sur le marché de ces nouvelles denrées nécessite donc de passer par plusieurs types d’approbations (relatifs à la sécurité alimentaire ou aux apports nutritionnels mais aussi à la concurrence sur le marché) comprenant un examen national par les autorités sanitaires et un arbitrage éventuel de chaque Etat. En Europe et notamment aux Pays-Bas, le gouvernement a octroyé plusieurs millions de dollars à la recherche dans le domaine. Aux États-Unis, le cadre juridique est un peu plus complexe et les subventions de recherches concernant l’agriculture cellulaire sont plus difficiles à dénicher.
Il ressort des dernières directives du Ministère américain de l’agriculture que l’agriculture cellulaire ne rentre pas dans le champ des missions prioritaires du Ministère. Les subventions accordées à la recherche sont donc peu importantes, ce dont se sont d’ailleurs plaint bon nombre d’intervenants lors de la conférence New Harvest. Lever des fonds pour les chercheurs et les jeunes pousses constitue donc un casse tête. Heureusement, des solutions se développent. L'organisation à but non lucratif New Harvest octroie ainsi des bourses de recherche. Elle a d'ailleurs donné naissance au premier poste de doctorant en agriculture cellulaire qui débutera en août prochain.
Le co-fondateur de Google y croit
À défaut de fonds publiques, les start-ups spécialisées sur le sujet parviennent tout de même à attirer les investisseurs privés (fonds en capital risque, business angels et entreprises). La Silicon Valley a cru en la tendance avant tout le monde. Ainsi, le signataire mystère du chèque de 250.000 euros versé à l’équipe de recherche du tout premier steak cultivé en laboratoire n’était autre que Sergey Brin, co-fondateur de Google !
Au delà des investissements et des régulations, le succès de ces initiatives tient au rapport de confiance créé avec les consommateurs, ce qui passe par une communication transparente et une exposition médiatique de grande ampleur. « Si nous souhaitons disposer de davantage de visibilité publique, nous devrions être plus structurés. Il faudrait construire une communauté de scientifiques pour montrer au monde ce que nous sommes en train de réaliser actuellement. Encore trop peu d’organismes étatiques sont impliqués. Le Ministre de l’agriculture américain devrait être beaucoup plus présent qu’il ne l’est aujourd’hui. Il en va de même pour la National Science Foundation [NSF]. Et il n’existe aucun mécanisme de financement à l’échelle fédérale. Un changement s’impose ! », s’est exclamé Mark Post lors de la conférence New Harvest.
La visiblité que recherchent tant les acteurs de l'agriculture cellulaire passera-t-elle par la commercialisation de produits haut de gamme, suivie par celle d'offres plus accessibles/grand public ? « On pourrait faire l’analogie avec Tesla et son modèle X. Il s’agit dans un premier temps de montrer aux consommateurs ce que nous pouvons réaliser à l’heure actuelle, d’ouvrir le champs des possibles en matière de saveurs, pour ensuite proposer une large gamme de produits pour le plus grand nombre » explique Camille Delebecque, fondateur et CEO d’Afineur, une start-up qui a développé un processus de fermentation naturelle pour améliorer les saveurs du café.
#cellularagriculture lacking public exposure & support from governmental #funding bodies #culturedmeat #newharvest pic.twitter.com/29D5uoMzpp
— Atelier US (@atelier_us) July 13, 2016
L’agriculture cellulaire rayonne au delà du secteur agroalimentaire
Pour remplir son ambitieuse mission, celle de développer des produits alimentaires de manière durable, sans avoir recours à l’élevage animal ou à la culture intensive de plantes, l’agriculture cellulaire promeut le développement de l’ingénierie tissulaire et de la biologie de synthèse. Or, les progrès réalisés dans ces deux domaines impactent également de nombreuses industries.
La santé, d’abord, où l’ingénierie tissulaire permet aujourd’hui la création de tissus humains (peau, cartilages, os) stables, capables de survivre dans le temps. Ce qui augure d’un bel avenir pour la chirurgie réparatrice et la transplantation d’organes.
La biologie de synthèse, quant à elle, ouvre de nouveaux horizons à l’industrie pharmaceutique. Cette technique, qui consiste notamment à reconstruir des systèmes biologiques présents dans la nature, permet de concilier avancées dans la recherche et sauvegarde des écosystèmes. Sothic Bioscience, une start-up irlandaise, recréé le composé organique appelé Limulus Amebocyte Lysate (LAL) présent dans le sang de certains limules (sorte de crabe qui vit dans les eaux d’Amérique du Nord surnommé en anglais « crabe en fer à cheval »).
Le LAL est une composante clé dans la création de médicaments. Il sert principalement pour les phases de tests, notamment à s’assurer que les médicaments sont sans danger pour l’homme. En utilisant des organismes vivants de type bactéries, l’équipe de Sothic Bioscience est capable de créer le composé organique du LAL, et donc de diminuer le risque d’extinction qui pèse sur cette espèce de crabe. En effet, selon les propos de Stephen Geary, fondateur de Sothic Bioscience, les trois quarts de l’espèce auraient disparu au cours de la dernière décennie.
La biologie de synthèse est également riche en possibilités pour le secteur textile. Modern Meadow est ainsi parvenue à créer du cuir de synthèse en reconstituant du collagène, protéine naturellement présente dans les cellules de la peau des animaux.
En fonction de l’usage final du produit, la structure de la matière comme son esthétique sont recréées de toute pièce. Spiber, une entreprise japonaise, planche depuis 11 ans sur la soie d’araignée, la fibre filée par les araignées. Elle a notamment développé, en partenariat avec The North Face, la première veste en soie d’araignée de synthèse, appelée « The Moon Parka ». Kenji Higashi, CEO de Spiber, présent à la conférence New Harvest détaille le procédé utilisé : « Nous utilisons des microbes pour développer nos protéines de synthèse qui donnent naissance à notre fibre. Elle est différente de celle créée naturellement par les araignées dans la mesure où nous en modifions quelque peu les propriétés : nous parvenons à obtenir des filaments plus longs, au diamètre plus épais, ce qui facilite la création du vêtement. La biologie de synthèse permet aujourd’hui de contrôler les propriétés et les fonctionnalités de matériaux et donc accélérer les processus de fabrication tout en ayant un impact bien moindre sur l’environnement ».
Les fibres synthétiques de l’industrie textile sont aujourd’hui obtenues par synthèse de composés chimiques issus quasi exclusivement d’hydrocarbures, comme le pétrole, le charbon et le gaz naturel, des ressources fossiles. En ce sens, la proposition de valeur de Spiber apparaît comme plus durable. Modern Meadow et Spiber partagent une même vision : le cuir comme la soie d’araignée ne sont qu’un premier point d’entrée dans le domaine de la biosynthèse de matériaux.
En somme, l’agriculture cellulaire, en s’appuyant sur le progrès des biotechnologies propose une alternative à la production animale traditionnelle plus respectueuse de l’environnement.
Son développement ne peut toutefois se faire sans l’action des gouvernements, seuls capables d’établir une législation pour encadrer la production et la commercialisation des produits issus de l’agriculture cellulaire. La communauté scientifique peut inciter les autorités à agir dans ce sens. Un travail de promotion sera également nécessaire, de la part des gouvernements comme des acteurs privés, pour faire connaître cette agriculture aux consommateurs. Son succès repose d’ailleurs sur la transparence quant aux techniques employées pour reconstituer les protéines et autres composés organiques. Cette transparence est aujourd'hui réclamée à grands cris par les consommateurs.
Réalisée en laboratoire, moins gourmande en espace que l’agriculture traditionnelle, l’agriculture cellulaire offre une solution idéale pour approvisionner les villes de demain, lieu premier de concentration de la population mondiale.
À lire aussi :
Quand les start-ups transforment nos assiettes
