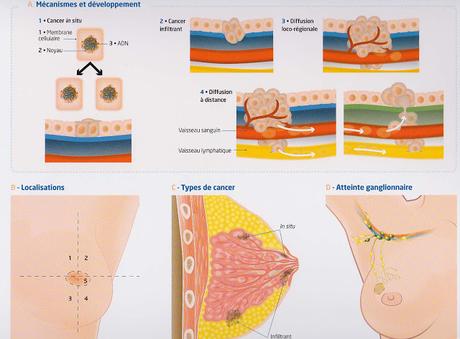
Cancer du sein. (doc Sanofi-Aventis, Dr Brigitte Sigal, Institut Curie Paris)
Source iconographique et légendaire: http://ims77.com/index.php?option=com_content&view=article&id=157
Dans cet essai de phase 3 prospectif, en double aveugle et contrôlé par placebo, des patientes préménopausées atteintes d’un cancer du sein à un stade précoce dont les cellules possèdent des récepteurs hormonaux positifs ; recevant un traitement anti-aromatase, étaient réparties de manière aléatoire sous ratio 1:1 pour recevoir soit denosumab 60 mg, soit le placebo administrés par voie sous - cutanée tous les six mois dans 58 centres en Autriche et en Suède. Les patients ont été réparties dans les groupes par système vocal interactif. Le tableau de randomisation a été établi à l’aide d’un système de permutation aléatoire de blocs - dimension des blocs : 2 et 4 - stratifiés selon le type d’hôpital relativement au modèle de dispositif médical Hologic utilisé pour les examens DXA (absorptiométrie biénergétique à rayons X), le statut de traitement anti-aromatase préalable, et la densité minérale osseuse à la ligne de base. Ni les patients, ni les médecins traitants, ni les investigateurs, ni les data managers, ni le personnel de l’étude n’avaient accès au tableau de randomisation. Le critère principal était le temps écoulé entre la randomisation et la première fracture clinique, analysés sur population en intention de traiter. En guise d’analyse de sensibilité complémentaire, le critère principal a également été analysé sur population per-protocole. Les patientes ont été traitées jusqu’à observation de la 247ème fracture clinique sur ladite population. Cet essai est toujours en cours (les patientes sont toujours suivies dans ce cadre). (…).
Entre le 18 décembre 2006 et le 22 juillet 2013, 3 425 patientes éligibles ont été recrutées pour cet essai, dont 3 420 ont été réparties de manière aléatoire pour recevoir le denosumab 60 mg (n=1711) ou le placebo (n=1709), par voie sous-cutanée pendant six mois. En comparaison du groupe placebo, les patientes du groupe denosumab ont présenté un temps de retard significatif d’événement de première fracture (hazard ratio [HR] 0.50 [Intervalle de Conficance (IC) 95% 0.39-0.65), p<0.0001). Le nombre global de fractures était diminué dans le groupe denosumab (92) par rapport au groupe placebo (176) était similaire dans tous les sous-groupes de patientes, y compris celles d’entre elles présentant un score T de densité minérale osseuse de -1 ou plus à la ligne de base (n=1872, HR 0.44 [IC 95% 0.31-0.64], p<0.0001) ainsi que chez celles d’entre elles présentant un score T de densité minérale osseuse de déjà inférieur à -1 à la ligne de base (n=1548, HR 0.57 [IC 95% 0.40-0.82], p=0.002). L’incidence d’événements indésirables dans l’analyse de sécurité (toutes les patientes ayant reçu au moins une dose du médicament à l’étude) n’a pas montré de différence entre le groupe denosumab (1366 événements, 80%) et le groupe placebo (1334 événements, 79%) ; de la même façon, le nombre d’événements indésirables graves n’a pas différé entre les deux groupes (521 versus 511 [30% dans chaque groupe]). Les événements indésirables principaux étaient arthralgie et autres symptômes liés à la prise d’anti-aromatases ; aucune autre toxicité en rapport avec le médicament à l’étude n’a été rapportée.Malgré les arbitrages proactifs des potentiels d’ostéonécrose de la mâchoire par un groupe international d’experts, aucun cas d’ostéonécrose de la mâchoire n’a été rapporté. 93 patientes (3% de l’ensemble d’analyse intégral) sont décédées au cours de l’étude, un décès (dans le groupe denosumab) étant imputable au médicament à l’étude.
Le denosumab 60 mg en adjuvant, administré deux fois par an réduit le risque de fractures cliniques chez les femmes postménopausées atteintes de cancer du sein recevant des anti-aromatases, peut être administré sans générer d’effets toxiques nouveaux. Du fait qu’un effet indésirable majeur d’un traitement adjuvant du cancer du sein peut être considérablement réduit par le denosumab, ce traitement devrait être considéré en pratique clinique. Prof Michael Gnant, MD, et al dans The Lancet, publication en ligne en avant-première, 31 mai 2015
Financement : Amgen
Source : The Lancet Online / Traduction et adaptation : NZ
