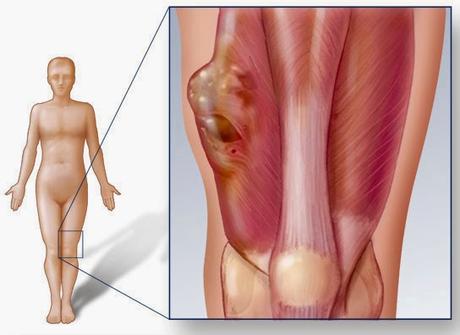
Sarcome des tissus mous. Le sarcome des tissus mous est une tumeur maligne envahissant les tissus conjonctifs. Le nom de la tumeur dépend du tissu conjonctif envahi : les tissus mous relient, soutiennent et entourent les organes du corps humain. Ils se trouvent entre la peau et les organes internes. Ils comprennent différents tissus tels que les muscles, les tendons, les tissus adipeux et fibreux ainsi que les structures articulaires ou le tissu nerveux. Les parties molles représentent plus de la moitié du poids du corps. Les tissus osseux ne font pas partis des tissus mous. Les sarcomes des tissus mous sont très rares. Ils représentent environ 0,5 à 1 % de tous les cancers diagnostiqués. Ils touchent un peu plus les hommes que les femmesSource iconographique et légendaire: http://www.swissorthoma.ch/refMedicales/Sarcome.htm
L’ombrabuline (AVE 8062) agit en dégradant le réseau sanguin de tumeurs déjà patentes, et a montré une activité antitumorale préclinique synergique lorsqu’administrée avec la cisplatine. Dans cet essai de phase 3, notre but était d’évaluer l’efficacité et l’innocuité d’ombrabuline + cisplatine en comparaison de placebo + cisplatine chez des patients atteints de sarcome des tissus mous avancé.Nous avons effectué cette étude de phase 3 multinationale, randomisée en double aveugle dans 44 centres situés dans dix pays. Les patients, âgés de 18 ans et plus, atteints de sarcomes des tissus mous métastatiques, présentant un statut de rendement ECOG (Eastern Cooperative Oncology Group) de 0-2, et qui avaient précédemment reçu un traitement à base d’anthracycline et ifosfamide, ont été répartis de manière aléatoire (1:1) pour recevoir une perfusion intraveineuse d’ombrabuline 25 mg / m2+ cisplatine 75 mg/m2 ou perfusion par voie intraveineuse de placebo + cisplatine 75 mg/m2 toutes les 3 semaines. Les patients ont été assignés aux traitements par le truchement d’une randomisation par blocs permutés (calibre du bloc : 4 sujets) générée par un système vocal interactif, et stratifiée par sous-type histologique. Ni les patients, ni le personnel médical, ni les investigateurs de l’étude, ni les data managers n’avaient accès au tableau d’attribution des traitements. Notre critère principal de mesure était la médiane de survie sans progression sur la population en intention de traiter. Les analyses d’innocuité étaient effectuées en comprenant tous les patients qui avaient reçu au moins une dose de médicament à l’étude.
Entre le 13 juin 2008 et le 26 avril 2012, nous avons randomisé 355 patients dans le groupe recevant ombrabuline + cisplatine (n=176) ou dans le groupe recevant placebo + cisplatine (n=179). La durée médiane de suivi était de 27.9 mois (Intervalle Interquartile [IQR] 20.9-33.2) dans le groupe placebo et de 30.5 mois (20.7-37.6) dans le groupe ombrabuline. La survie sans progression de la maladie était légèrement mais significativement améliorée dans le groupe ombrabuline en comparaison du groupe placebo (médiane : 1.54 mois [Intervalle de Confiance -IC- 95% 1.45-2.69] versus 1.41mois [1.38-1.58] ; hazard ratio 0.76 [IC 95% 0.59-0.98] ; p=0.0302).Les événements indésirables de grade 3 ou 4 sont survenus plus fréquemment chez les sujets du groupe ombrabuline que chez les sujets du groupe placebo ; ils incluaient neutropénie (34 [19%] dans le groupe ombrabuline versus 14 [8%] dans le groupe placebo) et thrombocytopénie (15 [8%] versus six [3%] pour le placebo). Les événements indésirables ayant pour issue le décès sont survenus chez 18 patients du groupe ombrabuline et 10 patients du groupe placebo.
La combinaison ombrabuline + cisplatine a amélioré de manière significative la survie sans progression de la maladie ; cependant, elle n’a pas montré un bénéfice clinique suffisant chez les patients atteints de sarcome des tissus mou avancé pour la proposer comme option thérapeutique. Il est nécessaire de trouver des biomarqueurs prédictifs pour le développement de médicaments agissant par la dégradation du réseau sanguin des sarcomes des tissus mous. Prof Jean-Yves Blay, MD, et al, dans The Lancet Oncology, publication en ligne en avant – première, 8 avril 2015
Financement : Sanofi
Source : The Lancet Online / Traduction et adaptation : NZ
