 Le processus de formation croisée de l’amyloïde est un lien possible entre la maladie d’Alzheimer et le diabète de type 2, suggère cette étude de l’Uppsala University (Suède), la première à apporter une explication à cette association déjà documentée. Ces conclusions, présentées dans l’American Journal of Pathology apportent ainsi des preuves d’effets de l’amyloïde du cerveau sur le pancréas…de souris.
Le processus de formation croisée de l’amyloïde est un lien possible entre la maladie d’Alzheimer et le diabète de type 2, suggère cette étude de l’Uppsala University (Suède), la première à apporter une explication à cette association déjà documentée. Ces conclusions, présentées dans l’American Journal of Pathology apportent ainsi des preuves d’effets de l’amyloïde du cerveau sur le pancréas…de souris.
Le processus pathologique de l’amylose, au cours duquel des protéines mal repliées (amyloïdes) forment des dépôts insolubles de fibrilles est caractéristique de la maladie d’Alzheimer (MA). Il se produit également dans le diabète. Cependant il existe différentes formes de protéines amyloïdes et on en sait encore peu sur le processus de formation amyloïde in vivo. On sait déjà que,
· des îlots amyloïde peuvent être trouvés dans les îlots de Langerhans chez presque tous les patients atteints de diabète de type 2.
· qu’un îlot amyloïde est composé de polypeptides amyloïdes des ilots (IAPP) dérivés du précurseur de la protéine IAPP (ProIAPP);
· que l’accumulation d’IAPP peut conduire à la mort des cellules bêta.
Diabète et double risque d’Alzheimer : D’autre part, plusieurs études ont déjà montré que les patients diabétiques de type 2 ont presque un risque double de développer la maladie d’Alzheimer. L’étude suggère que ce lien peut venir du processus sous-jacent de l’amylose. Au départ, les chercheurs ont voulu comprendre comment les dépôts amyloïdes se développaient de manière disséminée dans un tissu ou se diffusaient d’un organe à l’autre.
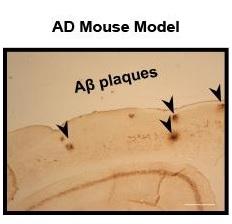
Le lien entre IAPP, régime riche en graisses et amyloïde : Gunilla T. Westermark, professeur au département de biologie médicale cellulaire à l’Université d’Uppsala (Suède) et son équipe ont injecté des souris transgéniques, exprimant l’IAPP humaine avec des fibrilles préformées de IAPP synthétique, proIAPP, ou bêta-amyloïde. Après 10 mois de régime alimentaire riche en graisses, le tissu a été analysé en utilisant un colorant spécifique de l’amyloïde. Le nombre d’îlots avec amyloïde s’avère considérablement augmenté par rapport aux souris contrôles. Les injections de fibrilles ont induit la formation d’amyloïde dans le pancréas –à l’exception d’autres organes-. De plus, ils constatent que l’amyloïde du cerveau peut » ensemencer » des fibrilles dans le pancréas.
Lorsque les scientifiques analysent des tissus humains du pancréas et du cerveau, ils constatent que les sections du pancréas avec îlots amyloïdes chez des patients diabétiques de type 2 ne montrent aucune immuno-réactivité vis-à-vis de bêta-amyloïde.
Les échantillons de tissu cérébral de patients atteints d’Alzheimer contiennent tous, en concentration 4 fois plus élevée qu’en cas d’autres maladies neurologiques, la protéine IAPP. En revanche, ils ne savent si IAPP identifiée dans le cerveau est produite ou dérivée de cellules bêta-pancréatiques.
Du pancréas au cerveau et vice et versa, un ensemencement croisé ? Cependant la recherche suggère ce que les chercheurs appellent un » ensemencement croisé » avec peut-être l’intervention d’autres agrégats amyloïdes ou d’autres types d’agrégats, venant déclencher la formation d’amyloïde. Les interactions entre amyloïde et d’autres protéines d’agrégation pourrait ainsi expliquer les liens entre différentes maladies liées à des anomalies des protéines.
Source: The American Journal of Pathology February 17, 2015 DOI: 10.1016/j.ajpath.2014.11.016 In Vivo Seeding and Cross-Seeding of Localized Amyloidosis


