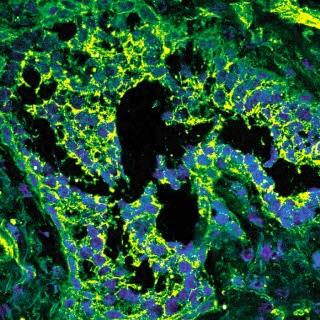
Cancer de la prostate
Le bisphénol A (BPA) donne la "bougeotte" aux cellules. La fluorescence verte indique la forte présence du canal ionique Orai 1 dans les tissus cancéreux de la prostate. Les noyaux des cellules apparaissent en bleu.
Inserm/Roudbraraki, MoradSource iconographique et légendaire: http://www.serimedis.inserm.fr/fr/asset/advancedsearchresults/page/1
Dans cette étude de phase 3 randomisée, en double-aveugle, et contrôlée par placebo, nous avons réparti les patients naïfs de chimiothérapie atteints de cancer métastatique de la prostate, en progression et résistant à la castration selon un ratio 1:1 pour recevoir docetaxel (75 mg/m2) au jour 1 et prednisone (5 mg deux fois par jour) aux jours 1 à 21 et [lenalidomide (25 mg) ou placebo] une fois par jour aux jours 1 à 14 à chaque cycle (durée du cycle : 21 jours) de traitement. La randomisation était effectuée par blocs permutés à l’aide d’un système de réponse vocale interactive et stratifiée en fonction de l’indice de performance ECOG (Eastern Cooperative Oncology Group), de la région géographique d’origine, et du type de progression de la maladie. Ni les cliniciens, ni les patients, ni investigateurs n’avaient accès au tableau de randomisation. Le critère principal était la survie globale. L’analyse d’efficacité était effectuée sur la population en intention de traiter. Les patients qui recevaient au moins une dose du médicament à l’étude étaient inclus dans les analyses d’innocuité. (…).
1059 patients ont été recrutés et répartis de manière aléatoire entre le 11 novembre 2009 et le 23 novembre 2011 (533 dans le groupe lenalidomide et 526 au groupe de contrôle). Au jour de clôture des données (13 janvier 2012), après une période médiane de suivi de 8 mois (Intervalle Interquartile [IQR] 5-12), 221 patients étaient décédés : 129 patients dans le groupe lenalidomide et 92 dans le groupe placebo. La durée médiane de survie était de 17.7 mois (Intervalle de Confiance [IC] 95% 14.8-18.8) dans le groupe lenalidomide, et non réalisée dans le groupe placebo (hazard ratio [HR] 1.53, IC 95% 1.17-2.00, p=0.0017). L’étude a été fermée prématurément pour raisons de futilité. Le nombre de sujets décédés en cours d’étude -pendant le traitement- ou survenant au cours des 28 jours suivant l’administration de la dernière dose de traitement était similaire dans les deux groupes (18 patients [3%] sur 525 dans le groupe lenalidomide versus 13 [2%] patients sur 521 du groupe placebo). 109 (21%) patients du groupe lenalidomide et 78 (15%) du groupe placebo sont décédés plus de 28 jours après administration de la dernière dose (médicament à l’étude ou placebo), principalement du fait de la progression de la maladie. Au moins un événement indésirable de grade 3 ou plus était rapporté chez 381 (73%) des 525 patients recevant la lenalidomide et 303 (58%) des 521 patients recevant le placebo. Neutropénies de grade 3-4 (114 [22%] pour lenalidomide versus 85 [16%] pour le placebo), neutropénies fébriles (62 [12%] versus23 [4%]), diarrhées (37 [7%] versus 17 [3%]), embolies pulmonaires (32 [6%] versus sept [1%]) sont des événements indésirables survenus plus fréquemment dans le groupe lenalidomide que dans le groupe placebo.
La survie globale sous combinaison de lenalidomide, docetaxel et prednisone s’est révélée significativement moins bonne que sous docetaxel et prednisone, sur une population d’hommes atteints de cancer de la prostate métastatique résistant à la castration et naïfs de chimiothérapie. De futures recherches relatives à cette combinaison de traitements n’est pas à recommander. Prof Daniel P Petrylak, MD et al, dans The Lancet Oncology, publication en ligne en avant-première, 2 mars 2015
Financement : Celgene Corporation
Source : The Lancet Online / Traduction et adaptation : NZ
