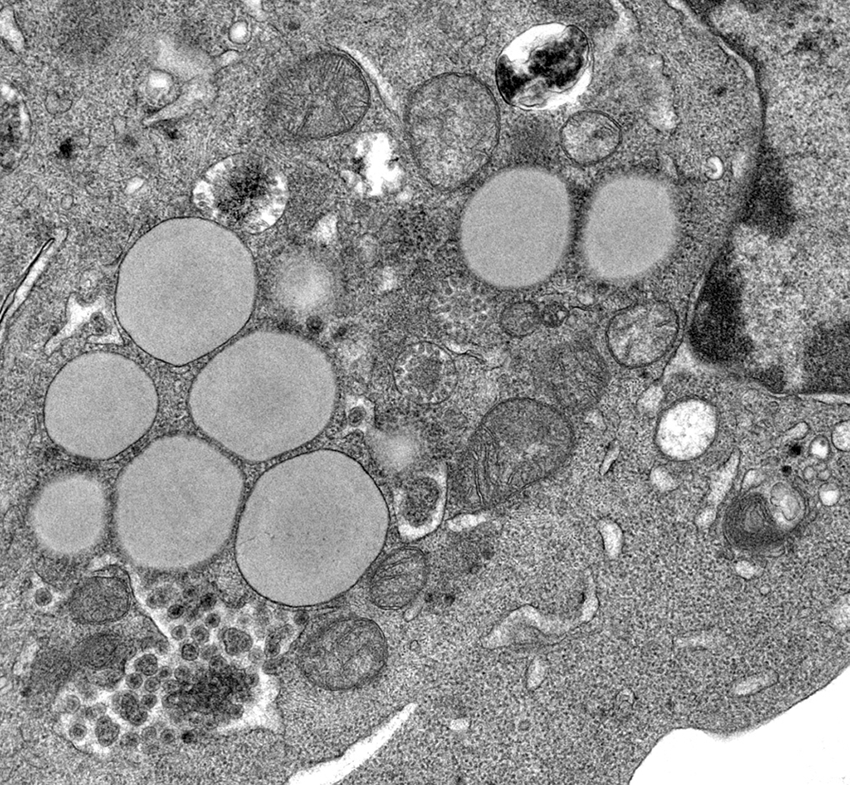
Les cellules infectées par le virus de l'hépatite C accumulent de grosses gouttelettes lipidiques, un phénomène appelé stéatose qui contribue au développement d'une fibrose du foie chez les patients atteints d'hépatite chronique C.
Source iconographique et légendaire: http://www.inserm.fr/thematiques/microbiologie-et-maladies-infectieuses/dossiers-d-information/hepatite-c
Dans cet essai monocentrique ouvert de phase 2A, nous avons recruté de manière séquentielle des patients atteints d’une infection à virus HCV de génotype 1 - qui n’avaient reçu aucun traitement au préalable - en trois groupes de traitements : 12 semaines de sofosbuvir et de ledipasvir ; 6 semaines de sofosbuvir, ledipasvir, et GS-9669 ; ou 6 semaines de sofosbuvir, ledipasvir et GS-9451. À la fois les patients et les investigateurs avaient accès au tableau de randomisation. Le critère principal de d’évaluation de l’étude était la proportion de patients montrant une réponse virale soutenue 12 semaines après achèvement du traitement (SVR12), confirmée par des concentrations d’ARN HCV inférieures à 43 UI/mL (limite inférieure de quantification). Nous avons effectué une analyse sur population en intention de traiter pour ce qui est du critère principal de l’étude et des événements indésirables. (…).
Nous avons recruté 60 patients entre le 11 janvier 2013 et le 17 décembre 2013, et les avons séquentiellement répartis en trois groupes de 20. Nous avons pu noter une SVR12 chez tous les 20 patients (100%, Intervalle de Confiance [IC] 95% 83-100) qui ont reçu les sofosbuvir et le ledipasvir pendant 12 semaines ; chez 19 (95%, 75-100) des 20 patients recevant le sofosbuvir, le ledipasvir et le GS-9669 pendant 6 semaines (un patient a montré une récidive deux jours après achèvement du traitement) ; et chez 19 (95%, 75-100) des 20 patients recevant le sofosbuvir, le ledipasvir et le GS-9451 pendant 6 semaines (un patient a été perdu de vu au suivi après avoir atteint une réponse virale soutenue à 4 semaines). La plupart des évènements indésirables étaient d’intensité modérée, et aucun patient n’a interrompu son traitement. Deux évènements indésirables graves sont survenus (douleur après biopsie hépatique effectuée après le traitement et vertige), d’occurrence indépendante des médicaments à l’étude.
Dans cette petite étude preuve de concept, deux différents schémas posologiques à trois médicaments administrés sur une période de 6 semaines ont eu pour résultat un taux élevé de guérison des infections HCV, avec une tolérance excellente. L’addition d’un troisième médicament antiviral puissant d’action directe peut permettre de réduire la durée de traitement nécessaire pour atteindre une réponse virale soutenue chez des patients atteints d’infection HCV de génotype 1 sans cirrhose. Anita Kohli MD et al, dans The Lancet, publication en ligne en avant - première, 12 janvier 2015
Financement : National Institute of Allergy and Infectious Diseases (NIAID), National Cancer Institute and Clinical Center Intramural Program, German Research Foundation, National Institutes of Health, Gilead Sciences.
Source: The Lancet Online / Traduction et adaptation: NZ
