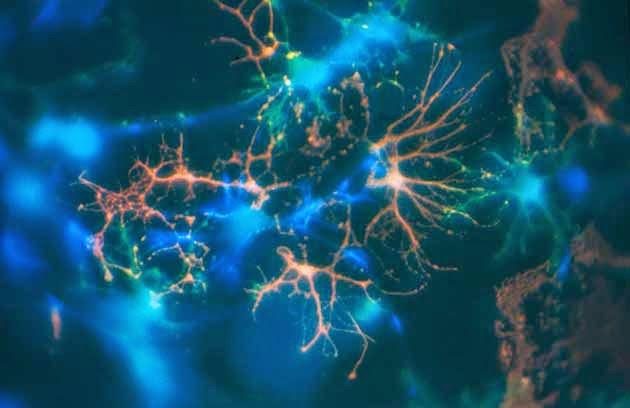
Mise en évidence des populations oligodendrocytaires présentes dans une culture gliale précoce dérivée de cerveau néonatal de souris. (...) Les enfants nés grands prématurés ont plus souvent des séquelles neurologiques que ceux nés à terme. Inserm, Corinne Demerens
Source iconographique et légendaire: http://www.inserm.fr/thematiques/biologie-cellulaire-developpement-et-evolution/dossiers-d-information/prematurite/prematurite-un-cerveau-sous-surveillance
L’étude Décodage des Troubles du Développement [Deciphering Developmental Disorders dans le texte] (DDD) a développé un réseau de recrutement des patients dans tout le Royaume – Uni, impliquant 180 cliniciens dans 24 services de diagnostic génétique régionaux, et a développé des biopuces permettant le séquençage de l’exome entier chez des enfants présentant des troubles développementaux non diagnostiqués, ainsi que chez leurs parents. Après analyse des données, les variants génomiques pertinents ont été appliqués à la recherche à titre individuel aux patients participants par l’intermédiaire de leur équipe de génétique clinique respective.
Environ 80 000 variants génomiques ont été identifiés à partir du séquençage de l’exome entier et l’analyse par biopuces chez les sujets, dont en moyenne 400 se sont révélés rares et supposés provoquer une altération des protéines. En nous penchant uniquement sur les variants de ségrégation nouveaux au niveau des gènes connus codant pour les troubles du développement, nous sommes parvenus à un rendement de diagnostic de 27% parmi les 1133 patients chez lesquels des investigations avaient été précédemment effectuées, en ne tenant pas compte des découvertes fortuites. Dans les familles dont les parents avaient eu un développement normal, le séquençage de l’exome entier de l’enfant et de ses deux parents a eu pour résultat une diminution de 10 fois du nombre de variants potentiels nécessitant une évaluation clinique, en comparaison d’un séquençage effectué chez l’enfant seul. La plupart des variants identifiés au diagnostiqués sur des gènes connus étaient nouveaux et non présents dans les bases de données actuelles recensant les variations dans les pathologies concernées.
L’implémentation de solides procédures de génomique translationelle est possible, dans le cadre d’une recherche de pathologie à grande échelle, permettant le passage des informations concernant des potentielles découvertes relatives aux diagnostics auprès des cliniciens et des participants aux essais. Une compilation systématique des données cliniques pertinentes, la gestion de la base de données gène-phénotype ainsi que le développement d’un logiciel d’aide à la décision clinique sont nécessaires; en sus de l’exclusion automatique de presque tous les variants, démarche cruciale pour la priorisation évolutive et un passage en revue des possibles variants de diagnostic. Les besoins en ressources et équipements nécessaires au développement et au maintien d’un système de rapports cliniques au sein d’un environnement de recherche restent très importants. Dr Caroline F Wright PhD et al, dans The Lancet, publication en ligne en avant – première, 16 décembre 2014
Financement : Health Innovation Challenge Fund, a parallel funding partnership between the Wellcome Trust and the UK Department of Health.
Source: The Lancet Online/Traduction et adaptation: NZ
