Une forme de mémoire mécanique qui ajuste l’élasticité des muscles à leur entraînement, c’est la découverte de ces chercheurs britanniques à l’aide de microscopes ultrasensibles à l’échelle atomique. Il s’agit d’une réaction biochimique qui augmente l’élasticité des protéines musculaires. Ces observations présentées dans l’édition du 13 mars de la revue Cell améliorent notre compréhension de la façon dont les muscles répondent à l’étirement, en fonction de leurs sollicitations passées. Elles pourraient conduire à de nouveaux traitements des troubles musculaires mais aussi des maladies du « muscle cardiaque ».
Pour le Pr Julio Fernandez de l’Université de Columbia, auteur principal de l’étude, qui travaille sur l’origine moléculaire de l’élasticité musculaire depuis plus de 20 ans, cette nouvelle étude représente la découverte d’un moyen efficace pour réguler élasticité musculaire. Ici, il s’est concentré, avec son équipe, sur une molécule spécifique, une protéine appelée titine.
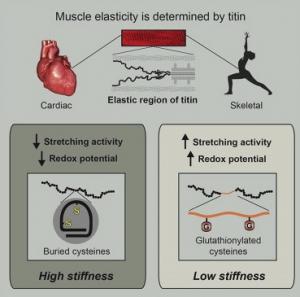
Mais qui est donc Titine ? C’est la plus grande des protéines mais surtout la plus abondante dans le muscle strié et la principale source d’élasticité musculaire. Chaque molécule de titine se compose d’une longue chaîne de faisceaux croisés ressemblant à une corde avec des centaines de nœuds. Titine a toujours été considérée comme une structure passive pour les muscles, mais ces nouveaux travaux révèlent le rôle crucial de titine, celui d’ajuster l’élasticité de chaque muscle de notre corps, de manière à ce qu’il fonctionne à performance optimale.
Activité musculaire et oxydation : Pendant l’activité musculaire, les niveaux d’oxydation augmentent avec le métabolisme élevé. Mais comment titine est-elle affectée par l’oxydation ? Les chercheurs constatent que titine contient un nombre inhabituellement élevé de sites (« hotspots ») sensibles à l’oxydation mais que la plupart de ces sites sont cachés dans les replis moléculaires et donc inactifs. Mais l’étirement d’un muscle va contraindre titine à se dérouler et, en exposant ses hotspots sensibles, à devenir elle-même de plus en plus sensible à l’oxydation. Lorsque titine s’oxyde –ici les chercheurs ont étudié une forme d’oxydation, la glutathionylation-la molécule reste bloquée à l’état déplié ce qui entraîne une baisse spectaculaire de sa rigidité. En l’absence d’oxydation, un effort musculaire ne va générer qu’un changement transitoire d’élasticité, de quelques secondes mais, en combinaison avec une oxydation (ou une activité musculaire intense) la force musculaire devient bien plus persistante. Et, en inversant l’oxydation, titine retrouve sa rigidité de départ.
Exercice physique et étirement : L’oxydation est favorisée par l’exercice physique mais c’est l’étirement qui la déclenche. Une fois l’oxydation déclenchée, elle va bloquer les protéines musculaires dans un état déplié ce qui augmente l’élasticité du muscle. Le muscle revient à la normale lorsque les cellules musculaires ont éliminé naturellement l’oxydation, un processus qui peut prendre plusieurs heures.
- Le cas du yoga : Ces nouvelles données permettent aussi de mieux comprendre les bénéfices du yoga et de ses étirements qui vont contribuer à déployer ou déplier la titine et consolider la mémoire mécanique des muscles.
Cette nouvelle compréhension du mécanisme et de la mémoire de l’élasticité musculaire pourrait conduire à de nouveaux traitements, concluent les auteurs, non seulement pour les troubles musculaires mais aussi pour certaines maladies du muscle cardiaque.
Source:Cell 13 March 2014 doi:10.1016/j.cell.2014.01.056S-Glutathionylation of Cryptic Cysteines Enhances Titin Elasticity by Blocking Protein Folding

