 Les gastro-entérites ("gastro" dans le jargon médical, terme que s'est approprié le grand public) surviennent par épidémies hivernales annuelles. Ces maladies désagréables mais bénignes chez l'adulte et le grand enfant peuvent être graves voire mortelles chez le très jeune enfant, du fait de la deshydratation occasionnée par des pertes digestives (vomissements et diarrhée) qui ne seraient pas compensées. Le principal coupable de ces gastro-entérites infantiles est le rotavirus. Une vaccination contre ce virus est disponible et recommandée en France depuis février 2014. Que peut-on dire de tout celà?
Les gastro-entérites ("gastro" dans le jargon médical, terme que s'est approprié le grand public) surviennent par épidémies hivernales annuelles. Ces maladies désagréables mais bénignes chez l'adulte et le grand enfant peuvent être graves voire mortelles chez le très jeune enfant, du fait de la deshydratation occasionnée par des pertes digestives (vomissements et diarrhée) qui ne seraient pas compensées. Le principal coupable de ces gastro-entérites infantiles est le rotavirus. Une vaccination contre ce virus est disponible et recommandée en France depuis février 2014. Que peut-on dire de tout celà?
Les coupables sont connus
Les gastro-entérites hivernales sont surtout d'origine virale. De nombreux virus peuvent être retrouvés. Outre les rotavirus sur lesquels nous reviendrons, on peut retrouver en France d'autres responsables, surtout des norovirus de type Norwalk et Sapporo (dénommés selon la ville où ils ont éte isolés initialement), des astrovirus (types 1 surtout) et des adénovirus (type 40 et 41). Chez l'enfant de moins de 3 ans, un virus, parfois deux, peuvent être mis en évidence dans 55% des recherches virologiques, dont un tiers de norovirus et un peu moins de rotavirus dans une étude de l'épidémie française de l'hiver 98/99 [1].
Une enquête portant sur les enfants hospitalisés dans un hôpital parisien pour gastro-entérite a démontré que 51% de celles-ci s'associaient à la présence de rotavirus dans les selles [2].
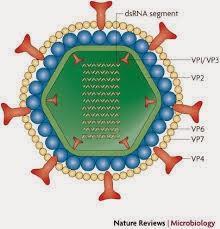
Schéma du rotavirus, noyau et ses trois capsides
Le rotavirus est un virus rond, entouré de spicules, qui a la forme d'une roue (issu du latin rota ). C'est un virus "nu" sans capsule mais entouré de trois couches de capsides protéiques autour d'un noyau dont les gènes sont de l'ARN. On décrit 7 groupes (A à G) de rotavirus dont seul le groupe A pratiquement s'intéresse à l'homme. Parmi ces groupes, on décrit de multiples sérotypes selon les spécificités de la capside externe. Ces caractéristiques sont dénommés par les lettres G et P suivies d'un numéro (20 sérotypes G et 14 sérotypes P connus). Les sérotypes les plus rencontrés sont surtout le G1 P[8], puis suivent le G2 P[4], G3 P[8], G4 P[8] et G9 P[8]. Ces cinq souches représentent 96% des infections humaines.Les rotavirus ont des caractéristiques qui les rendent très pathogènes et adaptés à leur hôte. Ils font partie d'un groupe de pathogènes qui ne seront jamais éradiqués car ils génèrent une immunité modérée et peuvent contaminer des espèces animales, avec des possibilités de recombinaison de leur ARN.
Résultats de l'enquête des gendarmes épidémiologistes
Les gastro-entérites à rotavirus sont des maladies obligatoires qui donnent lieu chaque année à des épidémies hivernales (décembre, janvier en France), chevauchant fréquemment l'épidémie de grippe. La fréquence des infections décroit avec l'âge, le pic de fréquence se situant entre 6 et 24 mois. Pratiquement tous les enfants avant l'âge de 5 ans auront été contaminés. La première rencontre de l'enfant avec le rotavirus est la plus sévère et confère un effet protecteur ultérieur partiel rendant les réinfections moins intenses voire asymptomatiques [3].L'excrétion virale asymptomatique existe chez un enfant sur deux avant l'apparition des premiers signes de la maladie (vomissements, diarrhée avec ou sans fièvre). L'incubation est courte (1 à 2 jours). Durant ces épidémies, l'excrétion virale dans les selles persiste ensuite environ une semaine après la guérison chez un tiers des enfants [4].
La contagiosité des rotavirus est très importante se faisant habituellement par voie inter-humaine par le biais de la voie fécale et des mains souilllées. Cette contamination peut aussi se faire par le biais d'objets inertes (jouets, linge, surfaces de change...) ou une contamination alimentaire. Les rotavirus sont en effet très résistants au savon et aux antiseptiques courants. Ils sont détruits par l'alcool à 95%. Ils peuvent survivre plusieurs jours sur une surface de l'environnement et plusieurs semaines dans les eaux usées.
Cette importante contagiosité explique les épidémies atteignant les collectivités (crèches, halte-garderies, maisons de soins pour personnes âgées) ou les services hospitaliers. En période hivernale épidémique, le rotavirus est la principale cause d'infections nosocomiales des services de pédiatrie [5]. Ces infections nosocomiales à rotavirus touchent des nourrissons plus jeunes que lors de l’infection naturelle. Ces infections acquises en milieu de soins représenteraient en France entre 4% et 15% des enfants hospitalisés en pédiatrie en période hivernale.
Qui sont les principales victimes?
Le risque des gastro-entérites virales est bien sûr la deshydrataion qui est d'autant plus à craindre que l'enfant est jeune et de petit poids. Ce risque engendre un nombre important d'hospitalisations dans tous les services de Pédiatrie chaque hiver. En 1997, les hospitalisations recensées en France dans les hôpitaux public ou privés ont répertorié 51.125 séjours hospitaliers chez des enfants de moins de 5 ans, avec un diagnostic codé gastro-entérite en diagnostic principal ou en diagnostic associé [6], dont on a vu plus haut que la moitié des cas était liée aux rotavirus.
En 2005, une autre étude française [7] a estimé à 300.000 le nombre annuel de diarrhées aiguës à rotavirus chez les enfants de moins de 5 ans et à 9 le nombre de décès. Ces infections seraient à l’origine de 138.000 consultations en ville par an et 18.000 hospitalisations. Les coûts médicaux directs annuels ont été estimés à 28 millions d’Euros. Les décès par gastro-entérites d'enfants de moins de 5 ans varient entre 0 et 6 par an selon les données 2002-2011 du CépiDc. Le Haut Conseil de Santé publique (HCSP) estime ce chiffre à 6 pour la saison 2009-2010.
Parmi les facteurs de risque d'hospitalisation pour infection à rotavirus, on dénombre plusieurs items dans une étude portant sur 349 enfants étatsuniens hospitalisés dans 3 hôpitaux différents, comparés à 1242 sujets contrôles [8]
- le petit poids de naissance inférieur à 2500 g.- la fréquentation d'une collectivité d'enfants- les enfants non couverts par une assurance privée (donc probablement de bas niveau socio-économique)- un âge maternel inférieur à 25 ans, avec un niveau de scolarisation n'ayant pas atteint les études secondaires- L'allaitement maternel est par contre içi un facteur de protection très net avec un risque d'être hospitalisé 5 fois plus important pour les enfants nourris au lait artificiel.
L'allaitement maternel protège donc des gastro-entérites en général et des infections à rotavirus en particulier, comme le montre une autre publication réalisée sur des enfants allemands [9]. Sur 1.256 échantillons de selles d'enfants (0-12 mois) atteints de gastro-entérites, 315 (25%) contenaient du rotavirus. Les enfants allaités par leur mère ont un risque d'être touchés par cette infection deux fois moindre (risque de 0,53) et ceci est encore plus net chez les nourrissons âgés de moins de 6 mois où le risque est trois fois moindre (0,33).
De quelles armes dispose-t-on en cas de "gastro"?

Le traitement curatif essentiel, voire unique, des gastro-entérites de l'enfant repose sur la lutte contre la deshydratation, seul risque de ces infections digestives. On dispose pour cela de ce que l'on nomme savamment des solutés de réhydratation orale (SRO). Leur remboursement est acté depuis 2003. Ces sachets de poudre contiennent un mélange bien proportionné de sucre et d'électrolytes (sodium, potassium, bicarbonates) que l'on mélange dans 200 ml d'eau minérale. Ce soluté reconstitué doit être proposé au nourrisson par petites quantités, sans forcage, de façon répétée et isolée durant les 12 premières heures. La quantité bue par le nourrisson n'a pas de limite et doit être adaptée à la soif de l'enfant. L'allaitement maternel, facteur de défense anti-infectieuse primordial, doit être absolument poursuivi.
Une réalimentaion très douce et progressive peut être tentée secondairement en utilisant de préférence un lait sans lactose chez l'enfant au biberon, voire des aliments cuits facilement digestibles (potages, purées, compotes..), tout en continuant bien sûr les apports hydriques.
Tout antibiotique serait bien sûr inutile et néfaste, en altérant la flore intestinale. Les médicaments anti-diarrhéiques (Tiorfan, Imodium...) sont des "médicaments symptomatiques" qui masquent le symptome diarrhée sans résoudre les pertes liquides. Leur prise orale parfois difficile risque de déclencher des vomissements aggravant la situation. Les probiotiques (Ultralevure, Lactéol...) sont d'efficacité douteuse et d'aucune utilité, tout du moins au début du traitement. Les pansements intestinaux (Smecta, Actapulgite...) sont d'acceptabilité délicate chez l'enfant, risquent de générer de nouveaux vomissements et sont plus des "médicaments de confort" de seconde attention, inutiles au départ. Des anti-émétiques en suppositoires (Vogalène) peuvent parfois rendre service au début de l'infection, en cas de vomissements répétitifs.

Le seul traitement des gastro-entérites essentiel et primordial repose sur la réhydratation orale, "doing the least" disent les anglo-saxons. Tout échec de compensation des pertes hydriques (vomissements incoercibles, diarrhée profuse) doit amener à reconsulter rapidement voire à hospitaliser l'enfant pour juger de l'opportunité d'une réhydratation par perfusion.
La vaccination, une arme de destruction massive?
Un premier type de vaccin vivant avait été commercialisé aux USA en 1998 sous le nom de Rotashield. Celui-ci fut retiré du marché moins d'un an plus tard, mis en cause dans la survenue de plusieurs cas d'invagination intestinale aiguë parfois mortelles [10]
L'efficacité mesurée sur la réduction du nombre de gastro-entérites à rotavirus et/ou sur la réduction du nombre d'hospitalisation parait très bonne à court terme. Les études cas-témoins montrent globalement une diminution du taux d'hospitalisation de 84% chez l'enfant de moins de 2 ans ayant reçu 2 doses vaccinales. On peut se reporter pour plus de détails au rapport du HCSP [11].
A signaler que les taux d'efficacité protectrice contre les infections à rotavirus sont les plus faibles dans les pays en voie de développement (Afrique noire) où les taux de mortalité par gastro-entérites sont les plus élevés.
L'efficacité du vaccin contre le rotavirus est également probablement moindre en cas d'allaitement maternel. Le rotavirus étant un vaccin vivant, ceci n'est pas étonnant. Le taux élevé d'IgA secrétoires secrétées par la glande mammmaire, l'activité neutralisante du lait maternel et le taux élevé de lactoferrine pourraient détruire rapidement les souches de rotavirus ingurgitées via un vaccin oral [12]. Ceci pourrait expliquer le moindre taux d'efficacité retrouvé dans les pays en voie de développement par rapport aux chiffres des pays industrialisés.
Le nombre important de combinaisons des sérotypes de rotavirus pourrait, à moyen et long terme, aboutir à un échappement de l'efficacité protectrice liée à une pression immunitaire, notamment vaccinale, et à l'éclosion de nouvelles souches. L’émergence au Brésil du génotype G2 P[4] dont la composition antigénique est différente de celle du vaccin monovalent Rotarix (G1 P[8]) a soulevé l’hypothèse de l’impact de cette pression immunitaire vaccinale.
"L’émergence des rotavirus de génotype G9 doit rester en mémoire car elle montre les importantes capacités d’adaptation à l’homme d’une souche d’origine animale. Ce génotype, également retrouvé chez le porc et le mouton, a été détecté pour la première fois chez des enfants diarrhéiques aux USA en 1983... Ce génotype s’est modifié par mutations successives et par réassortiments sélectifs avec d’autres segments génomiques pour finalement s’adapter parfaitement à l’homme" [11]
Effets collatéraux du vaccin
Ces vaccins s'ils sont efficaces, sont-ils anodins? Quel est le risque d'invagination intestinale qui avait été décrit après le vaccin de première génération? Il semble bien exister un excès de risque d'invagination post-vaccinale surtout à partir d'un certain âge de réalisation trop tardive du vaccin.
Une étude réalisée en Allemagne [13] a permis d'estimer l'incidence annuelle des invaginations selon l'âge:
- 19.2/100.000 enfants dans les 3 premiers mois de vie.
- 98.5/100.000 enfants au-delà et jusqu'a 8 mois.

Donc, déjà sans vaccin préalable, l'invagination est 5 fois plus fréquente après l'âge de 3 mois. Pour mémoire elle est plus fréquente chez le garçon (1.7 pour 1 fille)
Une autre étude allemande récente [14] a repris les cas d'invagination recensés entre 2006 (année du début de la commercialisation des vaccins dans ce pays) et 2010, comparés au nombre de cas attendus. Pour la tranche d'âge globale des enfants de moins d'un an, il n'y a pas d'excès de cas dans les 7 jours suivant l'absorption de n'importe quelle prise d'un vaccin. Si par contre, on se penche sur la tranche d'âge 3-5 mois, il existe ici un excès de cas dans la fenêtre des 7 jours suivant la première prise d'un vaccin Rotarix (risque relatif = 4,6) ou Rotateq (risque relatif = 5,8). Pas de risque accru avant l'âge de 3 mois, ce qui fait recommander aux auteurs de débuter la vaccination contre le rotavirus, lorsqu'elle parait souhaitable, avant cet âge pour minimiser ce risque. A signaler cependant le faible cas d'invaginations (27) comptabilisées, ce qui donne à cette étude une puissance statistique moyenne.
En Australie, l'estimation de sur-risque d’invagination post-vaccinale montre un risque relatif majoré par un facteur de 6.8 dans les 7 jours après l’administration de la première dose de Rotarix et de 9,9 pour un Rotateq. Le sur-risque global d’invagination attribuable pour chacun des deux vaccins a été évalué à 5,6 cas pour 100.000 enfants vaccinés [15] à partir du recueil de 306 observations d'invagination sur 3 années.
L'autre incident de parcours de ces vaccins a été la découverte, en 2010, d'une contamination par de l'ADN d'un circovirus porcin du vaccin Rotarix, puis un peu plus tard de son concurrent, le Rotateq. Cette découverte n'a pas donné lieu, à cette période, à des signes cliniques ou immunologiques d'infection à ce virus animal chez les enfants ayant reçu ces vaccins. Ceci démontre cependant le risque de pollution par des contaminants lors de la fabrication de ce type de vaccins vivants.
Quel usage optimal pour ce vaccin?
L'OMS a décidé, en 2009, d'inclure cette vaccination dans tous les programmes nationaux de vaccination, en particulier dans les pays où le taux de mortalité par diarrhée dépasse 10% chez le jeune enfant de moins de 5 ans.
Le HCSP vient de recommander en France, depuis février 2014, la vaccination généralisée de tous les nourrissons par l'un de deux vaccins vivants oraux actuellement sur le marché depuis 2006 [11]. Ces vaccins ne sont pas encore remboursés (Rotarix = 137,80 € pour 2 doses, Rotateq = 161,50 € pour 3 doses) mais devraient l'être dans les mois à venir.
Cette décision parait avoir été prise dans un climat de lobbying intense de la communauté pédiatrique et des laboratoires producteurs [16] puisque qu'en 2010, la même institution n'avait pas recommandé cette attitude du fait d'un rapport coût-efficacité insuffisant [17]
Certains auteurs (Pays-Bas) préconisent plutôt une vaccination ciblée dans les pays industrialisés chez les enfants à risque (prématurés, petit poids de naissance, enfants porteurs d'une malformation grave) [18]
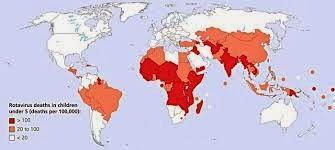
Incidence de mortalité des enfants de < 5 ans/100.000
Cette vaccination systématique serait surement la plus utile et favorable dans les pays à bas niveau socio-économique (Afrique noire, Asie) où le taux de mortalité des jeunes enfants par diarrhée et deshydrataion est le plus lourd. Afin d'améliorer l'efficacité vaccinale une première prise le premier jour de vie serait préconisée.Le meilleur vaccin contre le rotavirus, le moins onéreux et celui dont l'efficacité parait plus que raisonnable reste donc le lait maternel. Un allaitement prolongé (au moins 6 mois) est un facteur de protection indéniable et encore plus efficace s'il peut être associé à une éviction des collectivités d'enfants (crèche, halte-garderie) dans les première année de vie. Notre pays ne se donne cependant pas les moyens de favoriser ces mesures élémentaires de prévention des infections de la petite enfance (gastro-entérites, bronchiolites, otites...). Notre législation du travail oblige les mères à ne bénéficier que d'un congé post-natal trop bref. Un ancien prématuré ou un petit poids de naissance ne devrait pas devoir être sevré précocément du sein de sa mère et ne devrait avoir rien à faire dans une crèche dans ses premiers mois de vie. Le rapport coût-efficacité de telles mesures est forcément positif.
Et le vaccin anti-rotavirus dans tout cela? Il apporte surement un plus chez les enfants à risque (petits poids de naissance, non allaités, gardés en crèche, de milieu socio-économique faible). Chez les enfants gardés à domicile et/ou allaités suffisamment longtemps, c'est sûrement un luxe de précaution de pays riches, avec une efficacité incertaine du fait de la destruction du virus vaccinal par les anticorps contenus dans le lait de femme. Et un risque d'invagination qui n'est pas nul.
Ce type de message est plus compliqué à faire passer auprès de la population que le fait de dire qu'il faille vacciner tout le monde et que "demain on rase gratis". Mais il pourrait être au moins un peu plus détaillé et expliqué auprès des professionnels de santé qui sont assez adultes pour pouvoir comprendre la complexité de certains problèmes de santé.
Dominique LE HOUEZEC
[1] CHIKHI-BRACHET R. et coll. Virus diversity in a winter epidemic of acute diarrhea in France. J Clin Microbiol. 2002 Nov;40(11):4266-72.
[2] MOULIN F. et coll.Hospitalization for acute community-acquired rotavirus gastroenteritis: a 4-year survey. Arch Pediatr. 2002 Mar;9(3):255-61.
[3] WHO.Report of the meeting on future directions for rotavirus vaccine research in developing countries. Geneva; 9-11 February 2000.
[4] RICHARDSON S.et coll.Extended excretion of rotavirus after severe diarrhea in young children. Lancet 1998;351(9119):1844-8.
[5] GLEIZES O. et colll. Nosocomial Rotavirus Infection in European Countries: A Review of the Epidemiology, Severity and Economic Burden of Hospital-Acquired Rotavirus Disease.Pediat Infect Dis J. 2006; Suppl. 25: S12-S21.
[6] FOURQUET F et coll. Acute gastro-enteritis in children in France: estimates of disease burden through national hospital discharge data Arch Pediatr. 2003 Oct;10(10):861-8.
[7] MELLIEZZ H et coll. Morbidity and cost of rotavirus infections in France. Med Mal Infect. 2005 Oct;35(10):492-9
[8] DENNEHY PH. A case-control study to determine risk factors for hospitalization for rotavirus gastroenteritis in U.S. children.Pediatr Infect Dis J. 2006 Dec;25(12):1123-31.
[9] PLENGE-BÖNIG A: Breastfeeding protects against acute gastroenteritis due to rotavirus in infants.Eur J Pediatr. 2010 Dec;169(12):1471-6
[10] CDC. Intussusception among recipients of rotavirus vaccine United States, 1998-1999.MMWR Morb Mortal Wkly Rep. 1999 Jul 16;48(27):577-81..
[11] HCSP. Vaccination des nourrissons contre les infections à rotavirus Recommandations.29 nov 2013
[12] MOON SS: Differential profiles and inhibitory effect on rotavirus vaccines of nonantibody components in breast milk from mothers in developing and developed countries.Pediatr Infect Dis J. 2013 Aug;32(8):863-70
[13].WEISS S.: Incidence of intussusception in early infancy: a capture-recapture estimate for Germany.Klin Padiatr. 2011 Dec;223(7):419-23.
[14] OBERLE D. Rotavirus vaccination: A risk factor for intussusception? Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz. 2014 Feb;57(2):234-241.
[15] CARLIN JB.et coll.Intussusception risk and disease prevention associated with rotavirus vaccines in Australia’s national immunisation programm. Clin Infecti Dis 2013; August 30.
[16] LELLOUCHE JP Vaccin rotavirus, le poids du lobbying P2diablog 23.02.2013
[17] HCSP. Vaccination sytématique contre le rotavirus des nourrissons âgés de moins de 6 mois. Mai 2010
[18] BRUIJNING-VERHAGEN P. Targeted rotavirus vaccination of high-risk infants; a low cost and highly cost-effective alternative to universal vaccination.(2013)
