 Percer à jour la structure de la protéine d’enveloppe du VIH est l’un des défis les plus difficiles en biologie, pour le développement de vaccins contre le VIH / sida. En utilisant des techniques d’imagerie de pointe, les chercheurs du Scripps Research Institute et de l’Université Cornell sont parvenus à décrypter la structure de cette protéine Env ainsi que son processus d’interaction avec les anticorps du virus. Les conclusions de cette étude financée par les National Institutes of Health (NIH) qui révèlent des "points d’entrée" de vulnérabilité, sont très précieuses pour le développement de vaccins anti-VIH.
Percer à jour la structure de la protéine d’enveloppe du VIH est l’un des défis les plus difficiles en biologie, pour le développement de vaccins contre le VIH / sida. En utilisant des techniques d’imagerie de pointe, les chercheurs du Scripps Research Institute et de l’Université Cornell sont parvenus à décrypter la structure de cette protéine Env ainsi que son processus d’interaction avec les anticorps du virus. Les conclusions de cette étude financée par les National Institutes of Health (NIH) qui révèlent des "points d’entrée" de vulnérabilité, sont très précieuses pour le développement de vaccins anti-VIH.
Les scientifiques ont utilisé 2 techniques d’imagerie, la cryo-microscopie électronique et la cristallographie aux rayons X pour déterminer la structure de la protéine d’enveloppe du VIH, une protéine en grande partie responsable de la pénétration du VIH dans les cellules immunitaires humaines et du développement de l’infection.
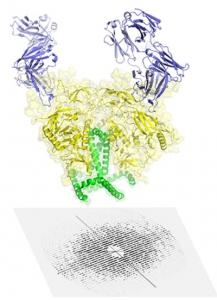
Une compréhension approfondie de la structure de la protéine Env, trimère (à 3 composantes) présente à la surface du virus est essentielle pour mieux comprendre comment le VIH réussit à entrer dans les cellules et pour développer des vaccins contre le VIH. L’image de haute résolution de la protéine Env était très difficile à obtenir en raison de la structure complexe de la protéine. Pour « capturer » cette image, les scientifiques ont dû d’abord concevoir une version plus stable de la protéine. Puis, en utilisant tour à tour les 2 techniques d’imagerie, ils sont parvenus à décrypter la structure de la protéine Env et les processus d’arrimage et d’interaction avec les anticorps qui ciblent le virus (ici sur le visuel sur 2 sites de vulnérabilité).
Source:Science Express October 31 2013
DOI: 10.1126/science.1245627 (2013)Cryo-EM Structure of a Fully Glycosylated Soluble Cleaved HIV-1 Env Trimer
DOI: 10.1126/science.1245625 (2013)Crystal Structure of a Soluble Dleaved HIV-1 Envelope Trimer
(Visuel@Scripps Research Institute)

