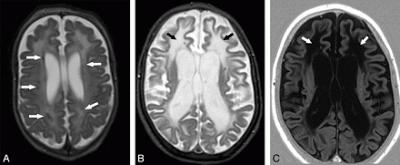
Leucoencéphalopathie. A: (...) Image RM (...) montrant des calcifications lobulaires de la matière blanche (flèches) (...). B et C: Anomalies très étendues de la matière blanche (flèches) au gradient antéropostérieur (patient B/C différent du patient A). In American Journal of Neuroradiology
Source iconographique et légendaire: http://www.ajnr.org/content/30/10/1971/F1.expansion.html
Le syndrome d'Aicardi-Goutières (AGS) est une encéphalopathie sub-aiguë à transmission mendélienne, associant classiquement des calcifications des noyaux gris centraux, une leucodystrophie et une lymphocytose du liquide céphalo-rachidien. Un peu plus de 120 cas ont été publiés dans la littérature (2008). (d'après Wikipedia, 2008)
Dans cette étude cas-témoin, des échantillons ont été collectés à partir de patients atteints d’AGS avec gène muté pour cause avérée. L’expression de six gènes stimulés par l’Interféron (ISGs) a été mesurée par PCR quantitative, ainsi que leur taux de changement d’expression – lors de la comparaison avec la moyenne des contrôles sains. Ces évaluations ont servi à définir un score interféron pour chaque patient. Les scores plus élevés que la moyenne des contrôles + 2 déviations standard -SD- (>2,466) ont été déclarés positifs. Nous avons, de plus, collecté les données historiques d’activité interféron évaluée par la mesure de l’effet cytopathique viral dans le liquide cérébrospinal (CSF) et le sérum des patients atteints d’AGS et porteurs de mutations. Nous avons également effectué des essais de neutralisation de l’activité interféron dans le sérum, et recherché la présence d’auto-anticorps contre un ensemble de protéines - interféron.
74 (90%) des 82 patients ont montré un score interféron positif (valeur médiane 12,90 ; Intervalle Interquartile [IQR] 6,14-20,41), en comparaison des deux (7%) des 29 contrôles (valeur médiane 0,93 ; IQR 0,57-1,30). Des huit patients porteurs d’un score interféron négatif, sept ont montré des mutations du gène RNASEH2B (sept [27%] des 26 patients porteurs de mutations dans ce gène). L’échantillonnage répété effectué chez 16 patients était pertinent pour ce qui est de définir la présence ou absence d’une signature interféron dans 39 cas sur 41. L’activité interféron (testée chez 147 patients) était négativement corrélée avec l’âge (CSF, r=-0,604 ; sérum, r=-0,289) ; et était plus élevée dans le CSF que dans le sérum chez 104 des 136 échantillons appariés. Les essais de neutralisation ont suggéré que l’activité antivirale mesurable était liée à la production d’interféron α. Nous n’avons pas enregistré de d’augmentation significative des concentrations d’anticorps aux sous-types d’interférons chez les patients atteints d’AGS, ou une association entre la présence d’auto-anticorps et un score d’interféron donné ou une activité interféron sérique.
Il existe une corrélation entre AGS et signature interféron, que cette corrélation se maintient dans le temps ; et peut donc servir d’outil fiable de différenciation entre patients atteints d’AGS et contrôles. Si de futures études devaient confirmer que l’interféron répond à la définition de biomarqueur réactif, la mesure du score d’interféron pourrait se révéler utile dans la mise au point de traitements efficaces pour les essais cliniques. Gillian I Rice PhD et al, dans The Lancet Neurology, publication en ligne en avant - première, 30 octobre 2013
Financement : Septième Programme Cadre de l’Union Européenne ; Conseil Européen de la Recherche
Source : The Lancet Online / Traduction et adaptation : NZ
