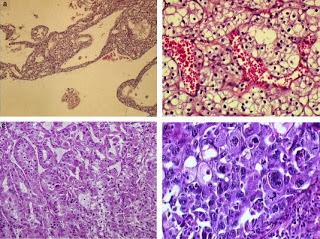
Carcinome rénal à cellules claires. 1a: Fuhrman1 (HES x 40) , 1b: Fuhrman2 (HES x 100), 1c: Fuhrman3 (HES x 100), 1d: Fuhrman4 (HES x 200). Dans Annales de Pathologie, Volume 28, Issue 5, Octobre 2008, Pages 374 - 380
Source iconographique et légendaire: http://www.sciencedirect.com/science/article/pii/S0242649808001934
Dans cette étude multicentrique de phase 2, randomisée en double aveugle, les patients ont été recrutés dans 49 centres de thérapie ambulatoire, en République Tchèque, Allemagne, Japon, Russie, Espagne et États-Unis. Les patients, atteints de carcinome métastatique des cellules rénales, n’ayant reçu aucun traitement préalable pour cette pathologie, ont reçu de l’axitinib à raison de 5 mg deux fois par jour pendant une période d’adaptation de 4 semaines. Les patients montrant une pression artérielle de 150 / 90 mm Hg ou moins, exempts d’effets toxiques de grade 3 ou de grade 4 liés au médicament à l’étude, n’ayant pas nécessité de baisse de dose de traitements administrés, et n’ayant pas reçu plus de deux traitements différents contre l’hypertension pour deux semaines consécutives, ont été stratifiés selon leur statut de rendement établi par l’Eastern Cooperative Oncology Group -ECOG – (0 versus 1), puis répartis de manière aléatoire (1:1) pour être titrés avec l’axitinib partant d’une posologie de 2 x 7 mg par jour à une posologie de 2 x 10 mg par jour (si tolérée) ou avec le placebo. Les patients ne satisfaisant pas aux critères d'inclusion, sont restés sans subir de titration. L’objectif principal de l’étude était de comparer les proportions de sujets montrant une réponse objective aux traitements entre les groupes de patients randomisés. Les analyses de sécurité ont été basées sur tous les patients recevant au moins une dose d’axitinib. (…).
Entre le 2 septembre 2009 et le 28 février 2011, nous avons recruté 213 patients, dont 112 ont été assignés de manière aléatoire soit au groupe titré axitinib (56 patients) soit au groupe titré placebo (56 patients). 91 patients n’étaient pas éligibles pour titration, et dix sont sortis de l’étude pendant la période d’adaptation. 30 patients (54%, Intervalle de Confiance [IC] 40 – 67) du groupe de titration axitinib ont montré une réponse objective au traitement, de même que 19 patients (34%, 22 – 48) dans le groupe de titration placebo (valeur unilatérale de p=0,019). 54 (59%, IC 95% 49 – 70) des patients non randomisés ont montré une réponse objective. Les événements indésirables de grade 3 ou plus, touts types confondus, chez les patients recevant un traitement étaient hypertension (dix [18%] des 56 du groupe titré axitinib versuscinq [9%] des 56 du groupe titré placebo versus45 [49%] des 91 du groupe non – randomisé), diarrhée (sept [13%] versus deux [4%] versus huit [9%]), baisse de poids corporel (quatre [7%] versus trois [5%] versus six [7%]). Un événement indésirable grave ou plus, tous types confondus, ont été rapportés chez 15 (27%) patients dans le groupe de titré axitinib, 13 (23%) patients du groupe titré placebo, et 35 (38%) du groupe de patients non-randomisés. Les événements indésirables les plus graves relevés chez les 213 patients étaient progression de la maladie et déshydratation (huit chacun [4%], et diarrhée, vomissements, pneumonie, et baisse de l’appétit (quatre chacun [2%]).
La plus grande proportion de patients du groupe axitinib montrant une réponse au traitement objective soutient le concept d’ajustement de dose d’axitinib à administrer chez des patients sélectionnés, atteints d’un carcinome métastatique des cellules rénales. L’axitinib a montré une activité clinique, avec un profil de sécurité gérable, chez des patients n’ayant pas reçu de traitement au préalable pour cette maladie. Prof Brian I Rini MD et al, dans The Lancet Oncology, publication en ligne en avant – première, 18 octobre 2013
Financement : Pfizer Inc.
Source : The Lancet Online / Traduction et adaptation : NZ
