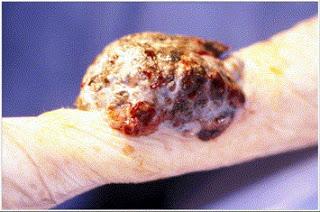
Tumeur noirâtre hémorragique de l'avant-bras de 8 cm x 6 cm x 3,5 cm évocatrice d'un mélanome nodulaire...
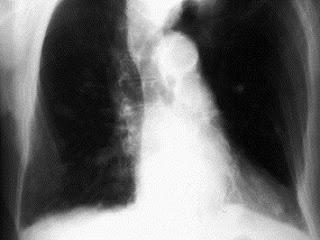
... avec multiples métastase pulmonaires bilatérales. In Chirurgie de la Main Volume 24, Issue 1, February 2005, Pages 42-44
Source iconographique et légendaire: http://www.sciencedirect.com/science/article/pii/S1297320304001726
Cet essai de phase 2, randomisé, en double aveugle, contrôlé par placebo avait pour objet l’étude de l’administration d’un traitement constitué de [selumetinib + dacarbazine] versus [placebo + dacarbazine] comme traitement de première ligne chez des patients âgés de 18 ans et plus, avec un mélanome cutané avancé, porteur de la mutation du gène BRAF, histologiquement confirmé par cytologie ou d’un mélanome primaire inconnu. Les patients ont été répartis de manière aléatoire par un système vocal intéractif -IVRS- (ratio 1:1, 4 patients par bloc) pour prendre soit du selumetinib per os (75 mg deux fois par jour sur un cycle de 21 jours) oule placebo ; tous les patients recevant de la dacarbazine par voie intraveineuse (1000 mg/m2 au jour 1 sur un cycle de 21 jours). Ni les patients, ni les investigateurs, ni le personnel de l’étude n’avaient accès au tableau de randomisation et de distribution des traitements. Le critère principal de mesure de l’essai était la survie globale, analysée sur population en intention de traiter. (…).
Entre le 20 juillet 2009 et le 8 avril 2010, 91 patients ont été répartis de manière aléatoire pour recevoir dacarbazine en combinaison avec selumetinib (n=45) ou placebo (n=46). La survie globale n’a pas montré de différence significative entre les groupes (médiane de survie globale 13,9 mois, Intervalle de Confiance – IC – 80% 10,2 – 15,6 ; dans le groupe selumetinib + dacarbazine versus le groupe placebo + dacarbazine ; hazard ratio [HR] 0,93 ; IC 80% 0,67 – 1,28 ; valeur unilatérale de p=0,39). Cependant, la survie sans récidive de la maladie était significativement améliorée dans le groupe selumetinib + dacarbazine versus le groupe placebo + dacarbazine (HR 0,63 ; IC 80% 0,47-0,84 ; valeur unlilatérale de p=0,021), avec une valeur médiane de 5,6 mois (IC 80% 4,9-5,9) versus 3,0 mois (2,8-4,6) ; respectivement. Les événements indésirables les plus fréquents incluaient nausée (28 patients [64%] sur 44 recevant le selumetinib versus 25 patients [56%] sur 45 patients recevant le placebo) ; dermatite acnéiforme (23 [52%] versus 1 [2%]) ; diarrhée (21 [48%] versus13 [29%]) ; vomissement (21 [48%] versus 15 [33%]) ; œdème périphérique (19 [43%] versus trois [7%] ). L’événement indésirable de grade 3-4 le plus fréquent était neutropénie (six patients [14%] dans le groupe selumetinib + dacarbazine versus quatre [9%] dans le groupe placebo + dacarbazine).
La combinaison selumetinib + dacarbazine a montré une activité clinique chez les patients atteints d’un mélanome cutané porteur d’une mutation du gène BRAF, ou d’un mélanome primaire inconnu ; reflétée par un bénéfice significatif en termes de survie sans progression de la maladie, en comparaison du groupe recevant placebo + dacarbazine. Toutefois, aucun changement significatif n’a été noté en terme de survie globale. La tolérabilité de la combinaison s’est montrée en rapport avec les profils habituellement observés en monothérapie. Dr Caroline Robert MD et al, in The Lancet Oncology, Early Online Publication, 2 June 2013
Financement: Astra Zeneca
Source: The Lancet Online / Traduction et adaptation: NZ
