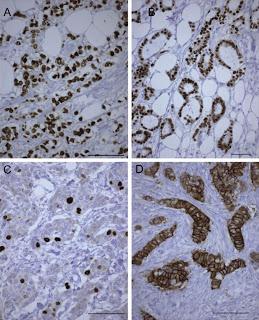
Immunomarquage des récepteurs aux estrogènes (A), du récepteur de la progestérone (B), du Ki67 (C) et du HER2 (D) de carcinomes mammaires différents (coloration hématoxyline-eosine, barre = 200 μm). In Imagerie de la Femme, Volume 20, Issue 1, March 2010, Pages 9-17
Source iconographique et légendaire: http://www.sciencedirect.com/science/article/pii/S1776981710000076
CLEOPATRA est une étude de phase 3 comparant l’efficacité et la sécurité de pertuzumab, trastuzumab et docetaxel avec placebo, trastuzumab, et docetaxel ; comme traitements de première ligne chez des patientes atteints de cancer du sein métastatique HER2-positif. Les résultats de l’analyse primaire ont montré une durée de survie médiane sans progression de la maladie significativement plus longue dans le groupe pertuzumab que dans le groupe placebo. L’analyse intermédiaire de la survie globale a montré la position la meilleure pour le groupe pertuzumab, mais non significative sur le plan statistique. Ici, nous rendons compte des résultats de survie globale après une année supplémentaire de suivi.
Cette étude était un essai en double – aveugle impliquant 204 centres situés dans 25 pays. Des patientes atteintes d’un cancer du sein métastatique HER2-positif, n’ayant reçu ni chimiothérapie ni traitement biologique préalables pour leur maladie métastatique ont été réparties au hasard pour recevoir soit pertuzumab, trastuzumab et docetaxel (n=402) ou ce même régime avec un placebo en remplacement du pertuzumab (n=406). La randomisation a été effectuée sous ratio 1:1, stratifiée par région géographique et profils de traitements reçus au préalable. Le critère principal d’efficacité mesuré était la survie sans progression de la maladie (étudiée de manière indépendante), dont il a été précédemment fait rapport (…). Les critères secondaires incluaient la survie globale, la survie sans progression (évaluée par l’investigateur), le taux de réponse objective, et la sécurité. La durée médiane de suivi a été de 30 mois dans les deux groupes. Les critères d’efficacité ont été analysés sur la population en intention de traiter et la sécurité analysée par traitement suivi. Cette étude est maintenant achevée, mais le recueil des données de sécurité et de survie sont toujours en cours. (…)
Dans la population en intention de traiter, 267 patientes étaient décédées à la date prévue de délivrance des données (14 mai 2012) : 154 (38%) sur 406 dans le groupe placebo et 113 (28%) sur 402 dans le groupe pertuzumab. La survie globale médiane était de 37,6 mois (Intervalle de Confiance – IC – 34,3 – NE [non estimable]) dans le groupe placebo ; significativement différente de celle observée (IC 95% 42,4 - NE) dans le groupe pertuzumab (hazard ratio 0,66 ; IC 95% 0,52 – 0,84 ; p=0,0008). La durée de survie médiane sans progression de la maladie, selon les observations de l’investigateur, était de 12,4 mois (IC 95% 10,4 – 13,5) dans le groupe placebo et de 18,7 mois (16,6 – 21,6) dans le groupe pertuzumab (hazard ratio 0,69 ; IC 95% 0,58 – 0,81). Des évènements indésirables graves étaient relevés chez 115 (29%) des 396 patientes qui recevaient placebo, trastuzumab et docetaxel ; et chez 148 (36%) des 408 patientes qui recevaient pertuzumab, trastuzumab et docetaxel. Ces évènements incluaient neutropénie fébrile, neutropénie, diarrhée, pneumonie, et cellulite. Dans l’ensemble, les profils d’évènements indésirables relevés étaient similaires à ceux rapportés dans l’analyse primaire pour ce qui est de leur fréquence, sévérité, et spécificité.
Notre analyse montre une amélioration significative de la survie globale avec pertuzumab, trastuzumab et docetaxel chez les patientes atteintes d’un cancer du sein métastatique HER2-positif, en comparaison de placebo, trastuzumab et docetaxel. Du fait que les évènements indésirables n’ont pas d’influence sur cet effet, ce régime représente une amélioration substantielle dans les traitements standards prodigués à cette population de patientes. Dr Sandra M Swain MD, in The Lancet Oncology, Early Online Publication, 18 April 2013
Financement: F Hoffmann-La Roche, Genentech
Source: The Lancet Online / Traduction et adaptation: NZ
