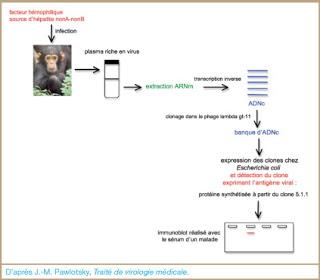
Processus de l'identification du virus de l'hépatite C (HCV). D'après J.M. Pawlotsky, Traité de Virologie Médicale. In Revue Française des Laboratoires, Volume 2009, Issue 417, December 2009, Pages 29 - 37
Source iconographique et légendaire: http://www.sciencedirect.com/science/article/pii/S1773035X09703077
Les inhibiteurs des protéases ont permis l’amélioration du traitement de l’hépatite C – à virus C – (HCV), mais la dose de médicament à administrer, une faible barrière à la résistance, les intéractions médicamenteuses et les effets secondaires, en ont restreint leur utilisation. Nous avons étudié la sécurité et l’efficacité du sofosbuvir, un analogue du nucléotide Uridine, chez des patients sans traitement antérieur, atteints d’une infection HCV à génotype 1-3.
Dans cette étude de phase 2 à deux cohortes, nous avons recruté des patients atteints d’infection HCV à génotype 1-3, sans traitement antérieur, provenant de 22 centres aux États - Unis. Tous les patients qui ont été recrutés entre le 16 août 2010 et le 13 décembre 2010 étaient éligibles pour inclusion s’ils étaient âgés de 18 à 70 ans inclus, montraient un profil de concentration en ARN HCV ≥ 50 000 UI/mL, et étaient exempts de cirrhose. Nous avons réparti au hasard tous les patients avec génotype HCV 1 (cohorte A) pour administration de 200 mg de sobosfuvir, 400 mg de sobosfuvir, ou le placebo (2 :2 :1) pour une période de 12 semaines en combinaison avec peginterferon (180 μg par semaine) et ribavirin (1000 – 1200 mg par jour) ; après quoi, un traitement supplémentaire peginterferon – ribavirin de 12 à 36 semaines leur était administré, dépendant de la réponse virale. La randomisation était effectuée à l’aide d’une séquence générée par ordinateur ; ni les patients ni les investigateurs n’ayant accès au tableau de randomisation jusqu’à la semaine 12. Les patients HCV 2 ou 3 (cohorte B) ont reçu 400 mg de sobosfuvir en ouvert + peginterferon et ribavirin pendant 12 semaines. Les paramètres principaux mesurés étaient sécurité et tolérance. Les analyses d’efficacité secondaire ont été effectuées sur population en intention de traiter et incluaient la mesure de réponse virologique soutenue, définie comme l’indétectabilité de l’ARN HCV post-traitement à semaine 12 et semaine 24. (…).
Dans la cohorte A, 122 patients ont été assignés à 200 mg de sofosbuvir (48 patients), 400 mg de sobosfuvir (48) ou au placebo (26). Nous avons recruté 25 patients dans la cohorte B. Les évènements indésirables les plus fréquents - fatigue, mal de tête, nausée et frisson - correspondaient à ceux associés à l’administration de peginterferon et de ribavirin. Huit patients sont sortis de l’étude du fait d'évènements indésirables, deux (4%) sous sofosbuvir 200 mg, trois (6%) sous sofosbuvir 400 mg, et trois (12%) sous placebo. Dans la cohorte A, l’ARN HCV post-traitement s’est montré indétectable à la semaine 12 chez 43 (90% ; Intervalle de Confiance – IC – 95% 77 – 97) des 48 patients du groupe sofosbuvir 200 mg ; 43 (91% ; 80 – 98) des 47 patients du groupe sofosbuvir 400 mg, et 15 (58% ; 37 – 77) des 26 patients du groupe placebo. Dans la cohorte B, 23 (92%) des 25 patients avaient un ARN HCV post-traitement indétectable à 12 semaines.
Nos résultats soutiennent l’initiative de futures études de phase 2 et 3, sur l’administration de sofosbuvir 400 mg + peginterferon et ribavirin sur une période de 12 semaines chez des patients atteints d’infection HCV 1, sans traitement préalable. Prof Eric Lawitz, in The Lancet Infectious Diseases, 15 March 2013
Financement : Gilead Sciences
Source : The Lancet Online/ Traduction et adaptation : NZ
