 En se liant de manière inhabituelle lie à la protéine hémagglutinine du virus, cet anticorps humain, C05, est capable de contrer un large éventail de souches de la grippe. Cette découverte, de scientifiques du Scripps Research Institute, publiée dans l'édition du 16 septembre de la revue Nature, est un pas certain vers le développement d'un vaccin universel et de nouvelles thérapies antivirales.
En se liant de manière inhabituelle lie à la protéine hémagglutinine du virus, cet anticorps humain, C05, est capable de contrer un large éventail de souches de la grippe. Cette découverte, de scientifiques du Scripps Research Institute, publiée dans l'édition du 16 septembre de la revue Nature, est un pas certain vers le développement d'un vaccin universel et de nouvelles thérapies antivirales.
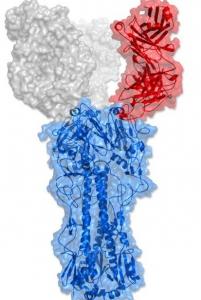
Ces scientifiques du Scripps ont mis à jour la structure cristalline d'un anticorps humain capable, d'une manière tout à fait unique, de neutraliser les virus grippaux : L'anticorps reconnaît la structure utilisée par les virus de la grippe pour se fixer aux cellules hôtes, même si auparavant cette structure avait été jugée trop petite pour qu'un anticorps puisse la cibler efficacement. La protéine immunitaire parvient à frapper cet endroit précis en utilisant seulement une petite partie de son mécanisme d'arrimage. Ainsi, l'anticorps est capable de neutraliser un large éventail de virus grippaux.
Une découverte fascinante : "Cette liaison très ciblée au site de liaison du récepteur en utilisant seulement une de ses boucles n'avait jamais été identifiée sur un anticorps auparavant » commente Ian A. Wilson, Professeur de Biologie au Scripps. Une découverte que les auteurs qualifient de fascinante, car elle apporte « quelques bonnes idées sur la conception de vaccins et de nouveaux traitements».
L'anticorps travaille comme un antiviral : Les chercheurs du Scripps Research ont effectué une collecte de moelle osseuse chez des patients exposés à certaines des principales souches de la grippe. Parce que la moelle osseuse conserve « une trace » de tous les anticorps d'un individu, les chercheurs étaient convaincus d'y trouver les anticorps qu'ils cherchaient et ont analysé les échantillons de moelle osseuse stockés dans une banque de données internationale de milliards d'anticorps. Avec la collaboration de la biotech Sea Lane Biotechnologies, les chercheurs ont pu isoler C05 capable de se lier aux protéines d'une famille, la plus dangereuse, de virus de la grippe. En laboratoire, C05 confirme sa capacité de protection, tout comme chez la souris, chez qui des doses relativement faibles de C05 parviennent à prévenir l'infection de la grippe A, malgré des niveaux d'exposition habituellement mortels. L'anticorps travaille comme un antiviral et guérit 100% des souris infectées lorsqu'administré 3 jours après l'infection.
C05 révèle, au-delà, une curieuse propriété : C'est le seul parmi les anticorps contre la grippe A, à reconnaître spécifiquement et à pouvoir bloquer le site d'attachement viral aux cellules hôtes. Connu comme le site de liaison du récepteur (receptor binding site-RBS), ce site viral est situé sur la tête des hémagglutinines virales, des structures hérissées en sucre et en protéines situées sur l'enveloppe virale et est relativement exposée au système immunitaire par rapport à d'autres régions virales. Ce serait donc une cible idéale pour les anticorps, sauf qu'il est assez petit par rapport à la surface de prise habituelle d'un anticorps.
Mais comment se lie un anticorps au virus ? Les auteurs nous expliquent qu'un anticorps se lie à ses cibles en utilisant 2 structures en forme de bras, dont chacun a 6 doigts de protéines ou de boucles. Pour obtenir une bonne adhérence un anticorps typique doit s'accrocher non seulement au site RBS mais aussi à quelques-unes des structures environnantes de la tête de la souche de grippe. Ainsi, un anticorps « normal » qui prendra emprise sur cette structure d'une souche de grippe en général, perdra cette fixation une fois que la souche aura muté. "C'est pourquoi les stratégies de vaccination universelle contre la grippe ont été davantage axées sur la tige de l'hémagglutinine que sur la tête du virus», explique Damian C. Ekiert, ex-chercheur au Scripps et co-auteur de l'étude. Ici, l'équipe montre que C05 évite de s'accrocher à des régions variables du virus et « accapare » le RBS lui-même. Et l'anticorps fonctionne encore mieux quand il saisit de 2 de ses boucles, une sur chaque bras, 2 sites RBS sur 2 hémagglutinines différentes. « Il semble que cet anticorps ait besoin de relier 2 hémagglutinines pour avoir un effet maximum», précisent les auteurs.
Une efficacité multi-virus : Le site RBS ne changeant pas beaucoup d'une souche à l'autre, C05 s'avère, en fin de compte efficace contre de nombreux virus et leurs sous-types H1, H2, H3, H9. «Si nous pouvons trouver le moyen de provoquer ce genre d'anticorps avec un vaccin, nous aurions alors un outil anti-grippe très efficace ».
Source: Nature 16 September 2012doi:10.1038/nature11414 Cross-neutralization of influenza A viruses mediated by a single antibody loop
Accéder aux dernières actualités sur le Vaccin universel

