
Et voilà! Ca fait un mois que je ne donne plus de nouvelles directement sur le blog. Alors heureusement, certains lecteurs savent que je suis encore vivant car je continue à papoter régulièrement sur la page Facebook de SSAFT, sur mon compte Twitter et je donne des signes de vie via mon activité pour l’animation de Strip Science. Tout ça prend du temps, mais ce qui m’a véritablement éloigné de mes activités blogistiques, ce sont les 3 stages de terrain auxquels je devais participer: un stage ‘Faune, Flore, Habitat’ de 2 jours à Chamarande, un stage ‘Traces et indices de Faune’ d’une journée à Avon, et un stage ‘écologie terrestre et volcanisme’ de 6 jours en Auvergne.
Cette année est en effet la première année où j’exerce la fonction de maitre de conférences et certains de mes cours se déroulent sur le terrain. Le hic, c’est que je n’ai jamais fait de terrain… Certes, ce n’est pas la première fois que je prépare un cours sans connaitre grand chose au sujet qu’il fallait enseigner (comme c’était le cas pour mon cours sur les amphibiens), mais l’expérience du terrain, c’est difficile à acquérir en lisant des livres ou en glanant des infos en ligne. Faut y aller! Du coup, c’est pas facile de garder une stature d’enseignant quand les étudiants peuvent lire dans vos yeux le désarroi du mec totalement paumé dans la nature (je suis Parisien de naissance… Le Bois de Boulogne, c’est déjà la cambrousse pour moi…).
Les tribulations que je vais vous conter, ce sont à la fois des exemples d’échecs retentissants, de gaffes, de coups durs à l’orgueil, mais aussi des découvertes scientifiques, des émois naturalistes, des astuces pédagogiques… Au final, ce sera le compte rendu d’une expérience que j’espère renouveler chaque année!
Mais commençons par le commencement, c’est à dire la…
Préparation
Même si on peut souvent critiquer l’absence d’intérêt pédagogique de certaines universités, l’équipe d’enseignement que j’ai intégrée cette année s’éloigne largement des stéréotypes et donne une importance primordiale à la formation des enseignants avant de les placer en face des étudiants. Du coup, cette année, je devais participer à ces stages sur le terrain mais en retrait, de manière à voir comment les autres enseignants délivrent leurs cours afin de pouvoir m’en inspirer les prochaines années. Et puis j’en ai profité pour apprendre les grandes lignes de ce que j’allais être mené à enseigner… Ben oui parce que la bonne blague, c’est que de l’écologie, de la zoologie pure et dure, et bien je n’en ai jamais fait durant mon propre cursus universitaire! Et ouaip, entre un DEUG en Biochimie et un Magistère de Génétique, on peut pas dire que j’ai véritablement tâté de la bestiole. Tout ce que je sais en zoologie et en écologie, c’est ce que j’ai acquis en regardant des documentaires, mes lectures, en potassant pour ce blog… et en préparant des enseignements! Comme quoi, y’a pas d’âge pour apprendre (et de moment opportun il semblerait…).
Autant dire qu’à la veille de mon premier stage, je me sentais aussi à l’aise qu’un poisson dans le vide intersidéral… Mais qu’à cela ne tienne, allons gaiement à…
Chamarande

Situé à 39km de Paris, Chamarande abrite, en plus d’un charmant village, un château qui est la propriété du département de l’Essonne et dans le parc duquel de nombreux espaces verts ont été dédiés à la conservation de la biodiversité ainsi qu’à l’exposition de grandes œuvres d’art contemporain.

Bref, c’est hautement classieux!
Le stage pour nos étudiants de M1 se partage en deux domaines, Biologie Animale et Biologie Végétale, pour réaliser un seul et même projet: remettre au responsable de la gestion écologique du parc un diagnostic sur l’état faunistique et floristique du site étudié. Boom! Grosse pression sur nos 9 étudiants qui vont se retrouver à être évalués non seulement par leurs enseignants mais aussi par un professionnel!
Pour la partie biologie animale, nous leur demandions d’échantillonner un maximum d’espèces sur le terrain, en privilégiant les espèces d’insectes. 2 parties du domaine étaient à échantillonner: une prairie et les berges d’un bassin et d’une rivière.
Nous étions 3 enseignants en biologie animale ce qui facilitait quand même énormément l’encadrement des étudiants (et me permettait de suivre un peu ce qui se disait près d’un groupe pour le répéter à un autre… Astuce number 1). La partie sur le terrain étant assez courte, il fallait essayer de récolter un maximum d’insectes en peu de temps et du coup procéder à l’identification des espèces une fois rentré au centre d’accueil où nous logions.
Ce fut pour moi l’occasion d’apprendre à me servir de plusieurs outils de collecte:
Le parapluie Japonais:

Un parapluie concave qu’on place en dessous d’un feuillage qu’on secoue ou qu’on frappe avec un bâton pour récupérer ses habitants qui tombent sur la surface du parapluie. C’est ce qu’on appelle entre entomologues le battage (moi j’ai pas encore le droit, je suis coccinelle de bronze…)
Le filet à papillon:

(Vous reconnaissez le travail de Laurent Laveder?) Le filet à papillon est l’outil parfait pour chasser tous les insectes volants. C’est aussi le moyen assuré d’avoir l’air d’un timbré en dévalant une prairie à la poursuite d’un papillon récalcitrant (du coup je le passais volontiers aux étudiants en prétextant que j’étais super chargé avec mon matériel photo… Astuce number 2!) Il y avait tout de même 2 aspects techniques à transmettre pour l’utilisation du filet à papillon: 1) Si on chope un papillon en plein vol, on est souvent tellement content qu’on a envie de jeter notre filet et de faire une danse de la victoire autour… C’est mal! Il faut tout d’abord s’assurer que notre prise ne s’enfuit pas! Et pour cela, voici la technique du petit coup de poignet:
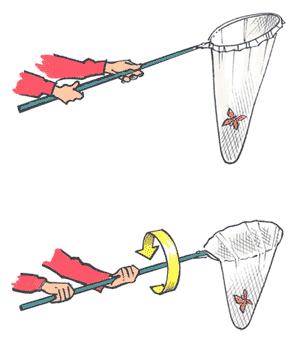
Comme ça, votre papillon est bien coincé! Ensuite vous pouvez reposer votre filet sur le sol et effectuer votre danse…
2) On pense le plus souvent à capturer l’insecte volant en plein vol. Mais il est en fait beaucoup plus facile de le choper une fois qu’il s’est posé. Exemple en image:

Le filet fauchoir:

Version terminator du filet à papillon, le filet fauchoir permet, comme son nom l’indique, de faucher la végétation pour récupérer rapidement la faune qui y loge tranquille. On réalise des battues sur quelques enjambées, on donne le ptit-coup-de-poignet™ et on regarde ce qu’on a récolté. Et attention, il faut une cadence réglée comme de l’horlogerie suisse:
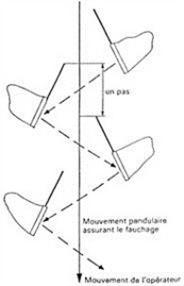
On avait deux filets fauchoirs à fournir aux étudiants: la version commerciale en photo plus haut et la version Rolland-Garros comme suit:

J’avais comme un faible pour la deuxième version pour ma part.
Le filet troubleau:

Pour choper la faune aquatique, on utilise enfin le filet troubleau qui permet de racler le fond tout en laissant passer l’eau et les sédiments mais en gardant captif nos larves et insectes adultes.
Bocal à Cyanure:

Toutes nos petites bestioles récoltées ne vont pas pouvoir être identifiées immédiatement. Pour éviter qu’elles ne s’abiment ou tout simplement pour les espèces les plus mobiles (comme les papillons), il faut se résoudre à tuer certains spécimens. On les transfère alors dans ces bocaux dont le fond est revêtu d’un plâtre mélangé à du cyanure. Une fois humecté, le plâtre lâche un gaz toxique qui tuera les insectes très rapidement.
La main:

Dotée de 5 doigts dont un pouce opposable, la main est également un outil de capture utile voire de prédilection pour la chasse aux insectes. Il existe cependant quelques petites limites à l’utilisation de la main comme la taille de l’insecte dans certains cas:

ou bien encore le facteur limitant de leur nombre qui n’est généralement qu’au maximum de 2. Ainsi, Charles Darwin, chassant des scarabées, a fait cette observation:
Un jour que j’arrachais à un arbre un morceau de vieille écorce, je vis deux étranges scarabées et en pris un dans chaque main. Puis j’en vis un troisième, une nouvelle espèce que je ne pouvais pas simplement laisser passer. Pour libérer l’une de mes mains, je mis dans ma bouche celui que je tenais dans la dextre. Hélas! L’insecte secréta un liquide fortement acide qui me brûla la langue : je dus cracher le scarabée, qui était ainsi perdu, tout comme le troisième.
L’appareil photo:

Il est parfois utile de récolter des clichés des insectes plutôt que de les ramener pour les identifier. Vu que je suis photographe amateur, ce fut pour moi l’occasion de mitrailler la faune avec mes divers objectifs (en proposant bien entendu de fournir les clichés aux étudiants pour compléter leur dossier… Astuce number 3!)
Pour le coup, je me suis régalé! Jugez-plutôt:
 Cantharide à labre jaune, Cantharis flavilabris
Cantharide à labre jaune, Cantharis flavilabris
 Coccinelle à 7 points, Coccinella septempunctata
Coccinelle à 7 points, Coccinella septempunctata
 Araignée-crabe Xysticus cristatus dévorant une mouche
Araignée-crabe Xysticus cristatus dévorant une mouche
 Coléoptère indéterminé
Coléoptère indéterminé
 Coléoptère indéterminé
Coléoptère indéterminé
 Tipule
Tipule
Une fois rentré au centre, on procède à l’identification à l’aide de clés d’identifications diverses et variées. Le mieux est d’arriver jusqu’à l’espèce de l’insecte collecté, mais on se contente souvent de la famille, voire du genre… Pour les spécimens qu’on a zigouillé, on peut passer à la préparation pour les collections. Pour certains c’est assez simple comme pour ce Hanneton commun (Melolontha melolontha):

Ca l’est moins quand il s’agit de préserver intactes et à l’horizontale les ailes de papillons. Pour y arriver, on utilise un étaloir qui permet de placer nos spécimens entre deux feuilles de papier sulfurisé ce qui évite d’écailler les ailes des papillons – et oui, les ailes des papillons ont des écailles: c’est ce qui laisse une sorte de poudre quand on les touche. D’où d’ailleurs le nom de l’ordre des papillons: Lépidoptères (lepidos voulant dire écailles en grec). Cette technique de l’étaloir permet que les ailes adoptent une position stable après environ une semaine:

Après une grosse journée de collecte et d’identification, deux ateliers nocturnes attendaient nos étudiants: un repérage de chauve-souris et une observation de la faune amphibienne d’une mare.
Repérer à l’œil les chauve-souris la nuit, c’est quand même sacrément difficile. Ce n’est pas pour rien qu’une des marques de fabrique de Batman soit ces apparitions et disparitions soudaines… On a quand même eu la chance de pouvoir en apercevoir quelques-unes virevolter au soleil couchant près du centre. Mais heureusement, j’avais au préalable contacté un expert en chiroptères qui a apporté plusieurs Batbox… Non, ce n’est pas un happeau à superhéros, c’est en fait un détecteur et enregistreur d’ultrasons qui permet de les retranscrire à fréquence audible pour les humains. Si vous avez l’occasion de vous en procurer ou de participer à une sortie de recensement de chauve-souris, n’hésitez pas! L’expérience est unique. Alors que vous pensez marcher dans une prairie calme sous un ciel étoilé, en branchant la batbox, vous vous retrouverez au milieu d’une cacophonie de cliquetis émis par pipistrelles, molosses et autres chiroptères en chasse. En moins de 30 minutes nous avions déjà détecté une dizaine d’individus et au moins 6 différentes espèces! Et puis on a même aperçu une belle grenouille verte:

Transition rêvée car ensuite, nous avons conduit les étudiants vers une mare où vivent quelques tritons palmés (Lissotriton helveticus), espèce protégée interdite à la capture. Seul le responsable de la gestion écologique avait le droit de les récolter pour l’observation, et encore, uniquement après avoir demandé une autorisation départementale… Mais bon, on va pas se plaindre car on a eu tout le loisir de les observer à défaut de les pêcher:


On a même trouvé des larves, portant encore leurs jolies branchies:

Fort de mon expérience lors de mon précédent TP, j’ai enfin pu ramener ma fraise et partager quelques de mes connaissances concernant les amphibiens… jusqu’à m’apercevoir que tous les étudiants connaissaient déjà leur cours jusqu’au bout des doigts…
Au hasard d’une collecte, on a réussi à observer aussi une larve d’odonate, l’ordre des insectes qui regroupe les libellules et les demoiselles. Un collègue enseignant nous a alors montré une des caractéristiques des larves d’odonates: le masque, c’est à dire leurs parties buccales qui sont hypertrophiées et articulées, particulièrement adaptées à la prédation:

Bon c’est peut être peu clair comme ça, alors je laisse la place à David Attenborough pour son habituelle excellente explication :
Traduction:
La nymphe ferme son orifice et ensuite contracte violemment son abdomen. A l’intérieur, la pression hydraulique monte, ce qui propulse les mâchoires vers l’avant.L’attaque est achevée en 2/100ème de seconde. La demoiselle n’a aucune chance. L’appétit des nymphes de libellules est vorace et elles doivent se nourrir nuit et jour. Elles peuvent même chasser en complète obscurité en utilisant leurs antennes et longues pattes pour détecter des ondes de pression. Rien est à l’abri, même muni d’une carapace. La nymphe utilise ses palpes pour composer une image de la proie en ondes de pression et vise le pied charnu de l’escargot. Une nouvelle victime mord la poussière.
On a d’ailleurs pu observer quelques odonates le lendemain lors de notre capture de la faune aquatique dont cette libellule venant tout juste d’achever sa mue imaginale:

Et cette demoiselle: une Nymphe au corps de feu.

Vous vous demandez pourquoi je vous bassine avec mes histoires de demoiselles et libellules depuis tout à l’heure? Et bien parmi les odonates, sachez qu’il y a le groupe des anisoptères (libellules, aeschnes et gomphes) et les zygoptères (demoiselles et agrions). Il y a pas mal de différences entre ces deux sous-ordres mais il y en a une qui ne trompe pas: quand elles se posent, les demoiselles ont leurs ailes le long du corps tandis que les libellules les ont maintenues à l’horizontale, de chaque côté du corps:

(Emilie Vanvolsem)
On a conclu ce fantastique stage avec une initiation à l’ornithologie, notamment à l’identification des oiseaux par le chant. J’en ai retenu qu’un… Le pouillot véloce:
Bref, vous l’aurez certainement compris: j’ai certainement autant appris que mes étudiants durant ce stage et je sens que j’ai encore du chemin à faire avant de pouvoir maitriser l’art de l’enseignant naturaliste. La bonne nouvelle c’est que j’ai encore plus de choses Strange et Funky à partager!
Liens:
Méthodes de Capture
Emission Silence ça Pousse tournée pendant le stage

