L’eau sous tous ses états, de la chimie, de la thermodynamique, et des expériences farfelues, tel est ce dont il est question !
NB : cet article se veut à la fois ludique et instructif. Si certains passages vous gonflent, vous êtes invités à les sauter !
Une expérience dangereuse
Dans le genre micro-ondes, après avoir relaté comment cet engin peut servir à mesurer la vitesse de la lumière, commençons par l’expérience qu’il ne faut surtout pas faire, au risque de perdre la vue. Certaines personnes ont en effet fini avec des brûlures du troisième degré au visage car elles ont… mis de l’eau au micro-ondes.
Depuis des temps immémoriaux, on enseigne que l’eau gèle à 0°C et bout à 100°C. Certes, cela n’est vrai qu’à pression ambiante, car plus la pression augmente, plus la température d’ébullition augmente, et donc plus les aliments cuisent vite : c’est le principe de la cocotte-minute. Ainsi, en raison de la dépression, en altitude, on peut faire chauffer des pattes à 90°C…
La raison en est toute simple : aux sommets, l’air pèse moins qu’en contrebas ; l’eau a donc tendance à s’évaporer plus facilement (lors d’un changement d’état il est question de pression de vapeur saturante).
Aussi, en hiver, on sale les routes afin qu’elles ne gèlent pas. En vertu de la loi de tonométrie de Raoult, la dissolution d’un composé ionique tel le chlorure de sodium (sel) abaisse la température de fusion.
Tout cela est donc la preuve qu’en matière de transitions de phase – c’est ainsi que s’appelle la branche de la physique étudiant les changements d’état – les observations sont à prendre avec des pincettes.
La surfusion
L’erreur à ne pas commettre (mettre autre chose qu’un plat cuisiné au micro-ondes, au passage ne jamais mettre un plat métal qui focalise la chaleur : risque d’explosion) provient d’un phénomène encore autre : la surfusion.
Ce qu’il se passe, c’est qu’en sortant sa tasse d’eau (ou de café) du micro-ondes, tout a l’air bien tranquille à l’intérieur. Mais les dents de la mer sont taries au fond de l’océan…
En effet, dès qu’on saisit la tasse et l’approchons de notre visage, le liquide bouillant gicle, comme par magie.
Dieu n’y est cependant pour rien… Car l’eau nous a trompé, naïfs que nous sommes de sortir la tasse comme si rien n’était ! L’eau n’est même pas bouillante, elle est calme, mais se trouve en surfusion : il va suffire d’un rien (en l’occurrence de sortir la tasse, ou d’y introduire un sachet de thé) pour qu’elle explose – et selon la qualité du matériau, la tasse peut exploser avec, projetant des éclats à la figure. La notion est capitale en chimie également, où certaines réactions nécessitent une énergie d’activation pour démarrer (c’est le cas de l’essence : une étincelle, et boom ; et le cas de nombreuses réactions biochimiques : dans le cadre du complexe activé, l’ATP, monnaie énergétique du vivant doit perdre un groupement phosphate pour amorcer une réaction chimique imminente). Précisons que la puissance de l’ATP (adénosine triphosphate) nous maintient au chaud à 37° C, été comme hiver ! La matière peut receler de l’énergie sous forme latente…
La métastibilité à l’oeuvre
On ne peut comprendre la surfusion sans évoquer la métastabilité, notion très simple : un corps est dit métastable lorsque sa stabilité ne tient qu’à un fil (typiquement, le château de cartes est métastable). C’est le cas des radionucléides utilisés en médecine nucléaire, tel le technétium métastable, un élément radioactif qui peut rester longtemps sans se désintégrer, mais qui, pour peu qu’on le déplace se désintègre subitement.

Illustration de la métastabilité : tout système physique tend à se rapprocher d’un puits de potentiel. C’est ainsi qu’une bille au fond d’un bol va au fond, car cette position minimise l’énergie potentielle due à la gravitation.
Le silence des agneaux
Ainsi donc, l’eau bouillante est en dormance. L’énergie cinétique mise en jeu lorsqu’on déplace la tasse amorce le changement d’état : une véritable bombe à retardement ! Ce n’est pas parce que l’eau peut bouillir à 100°C qu’elle va nécessairement le faire », explique le physicien Louis Bloomfield dans son ouvrage How Everything Works. Making Physics Out of the Ordinary.
De même, quand on affirme “l’eau gèle au-dessous de 0°C”, on exprime en fait l’état dans lequel elle devrait être, mais non pas l’état dans lequel elle est forcément !
Et la surfusion, ça ne sont pas des bobards ! Les pilotes de lignes ont quelques connaissances en thermodynamique afin d’appréhender les pluies verglaçantes : l’eau ne gèle qu’en touchant l’avion, mais ce phénomène se produit aussi au sol, où les gouttes ne gèlent qu’à l’impact.
Ce déclenchement par choc est également un des principes des chaufferettes à main. Elles contiennent un liquide surfondu (de l’acétate de sodium) qui se met à cristalliser en cas de choc. La réaction de cristallisation est exothermique, ce qui réchauffe nos mains !
Aussi, sous certaines conditions l’eau chaude au congélateur gèle plus vite que l’eau froide. Ce phénomène curieux, mais avéré, connu sous le nom d’effet Mpemba est attesté depuis l’Antiquité. Il est contraire aux lois de Fourrier sur la diffusion de la chaleur, mais d’aucuns ne s’accordent pour dire que l’effet Mpemba est en partie due à la surfusion de l’eau.
Une simple rayure…
Dans l’affaire de la tasse au micro-ondes, pour démarrer l’ébullition cependant, il faut un “point de départ” à l’ébullition, une minuscule bulle qui se formerait et qui croîtrait par la suite. Toutefois, écrit M. Bloomfield, cela n’arrive à peu près jamais spontanément dans une eau sous 300 °C (!), si bien qu’il faut que quelque chose donne au liquide la petite poussée qui lui manque pour former des bulles de vapeur – que ce soit une impureté en solution, ou alors un défaut, une rayure, quelque aspérité dans le fond du contenant.
Rouge à lèvres et bulles de champagne
Peut-être les femmes amatrices de champagne l’auront-elles remarqué : le rouge à lèvres et les bulles ne font pas bon ménage. Les composés chimiques contenus dans le rouge à lèvres contribuent en effet à détruire les bulles. Pour peu qu’on pousse ce raisonnement à outrance, les impuretés dans le verre auraient aussi à tendance à détruire les bulles. Eh non ! Au contraire, un champagne sans poussière, dans un verre ultra propre donc, ne bulle pas beaucoup.
Les impuretés peuvent être de toute nature : des dépôts de calcaire, de tartre, des fibres de celluloses provenant du torchon utilisé pour essuyer le verre ou des poussières en suspension dans l’air qui sont venues se déposer dans ce même verre. Au moment où l’on verse le champagne dans la coupe, ou la flûte, ou le verre, une microscopique poche de gaz est piégée par ces impuretés et c’est à leur contact que les bulles de dioxyde de carbone du champagne vont se former. Elles vont en quelque sorte se sentir libérées de la pression du liquide qui les entoure. Mais ce phénomène, qui fait notamment intervenir l’électricité statique, n’est pas inconnu : lorsqu’on trempe une paille dans un verre (plutôt de soda !), les bulles se forment davantage au contact de la paille.
Le meilleur pour la fin
Sans jouer les rabats-joies, car la surfusion est un phénomène extraordinaire, il convient de s’interroger sur les raisons physiques du phénomène. Car depuis le début je vous mène en bateau… Finalement, on n’est pas plus avancés : pourquoi l’eau ne bout-elle pas à une température supérieure à son point d’ébullition ? Plus précisément, à quoi est dû à cet équilibre métastable ?
En matière d’ébullition, il ne faut rien conclure hâtivement. Les mélanges azéotropes en sont la preuve : leur température d’ébullition n’est pas comprise entre celle des constituants !
Qu’on se le dise : la surfusion est due à l’énergie de tension superficielle à l’interface solide-liquide.
Quésako ? Tension superficielle !
Un été, alors que je n’avais pour ainsi dire pas grand chose à faire que de m’amuser avec du liquide vaisselle et du poivre, j’avais tourné cette vidéo on ne peut plus basique :
J’ai sur le doigt du liquide vaisselle, sinon l’index dans l’eau n’eût jamais écarté le poivre dans l’assiette remplie d’eau.
Cette expérience illustre les forces de tension superficielle, lesquelles sont à l’origine d’un phénomène connu de tous : les insectes qui marchent sur l’eau.

Gerris lacustris aime se promener sur l’eau, pourtant la fameuse poussée d’Archimède ne lui assure pas de flotter.
Un trombone peut également flotter à la surface de l’eau, pour peu qu’on le dépose délicatement, et en arasant la surface, sinon la tension superficielle de l’eau, qui agit comme une fine pellicule sustentatrice, est cassée et il coule. Dans l’expérience-vidéo, le poivre matérialise les molécules : c’est comme si toutes les petites choses qui forment la surface de l’eau se donnaient les mains pour s’empêcher de tomber.
Le liquide vaisselle est ce qu’on appelle un agent tensioactif : le détergent prend la place des molécules d’eau, diminuant ainsi la tension superficielle. Conclusion : c’est l’arme idéale pour noyer une araignée de mer…
Maintenant, comment s’explique la tension superficielle ? En recourant à autre chose encore… les lézards et les insectes qui marchent au plafond !

Le tarente de Maurétanie (Tarentola mauritanica) n’a que faire de la gravité : il se meut au plafond, comme bon nombre de geckos !
Les molécules d’eau s’attirent en effet mutuellement à cause des liaisons hydrogène. Pour les puristes, la liaison hydrogène est une liaison non covalente, c’est-à-dire qu’elle ne résulte pas de la mise en commun d’électrons entre atomes (ce n’est pas une véritable liaison chimique, telle que celle qui lie l’atome d’oxygène aux deux atomes d’hydrogène dans la molécule d’eau). Si la liaison hydrogène ne fait pas intervenir d’électrons de valence, elle n’en demeure pas moins puissante, du moins assez pour assurer les forces de tensions superficielles (et au passage la vie : si les liaisons hydrogène n’assuraient pas la cohésion au sein du site actif des enzymes, aucune réaction chimique n’aurait lieu, et nous ne serions pas là pour glousser).
En fait, les liaisons hydrogène sont dues à la différence d’électronégativité entre les atomes, en l’occurrence l’oxygène est beaucoup plus électronégatif que l’hydrogène ; ce qui signifie que dans la molécule d’eau l’oxygène a tendance capter les deux électrons mis en jeu dans la liaison covalente.
Je gage que vous me suivez ! L’oxygène, plein aux as (bourré en électrons) est ainsi chargé négativement – puisqu’il ne faut pas oublier qu’un trop-plein d’électrons (chargés négativement) entraîne une charge globale négative. A l’inverse, l’hydrogène, pauvre en électrons, puisqu’il les a cédés à l’oxygène,
Du fait de l’existence de fortes liaisons hydrogène, la molécule d’eau est polarisée : on dit que l’eau est un solvant polaire, et ceci se ressent sur ses propriétés chimiques : pour cette raison, l’eau a tendance à ioniser les composés introduits, c’est-à-dire qu’en versant du chlorure de sodium (NaCl) dans de l’eau, le sel de table se dissocie en ions Na+ et Cl- : c’est la solvatation. Mais surtout, l’eau est un solvant polaire protique : puisque l’oxygène s’accapare tous les électrons, la liaison oxygène-hydrogène est fragilisée. Ne tenant qu’à un fil, et un composé chimique n’aura pas de mal à piquer un atome d’hydrogène à la molécule d’eau. Atome d’hydrogène chargé positivement (en raison de son déficit en électrons), donc proton, d’où le terme protique ! Cette capacité de l’eau à céder facilement un proton est à l’origine de sa réactivité acidobasique, et je n’aurai pas l’audace de faire un couplet pour vous dire que notre métabolisme est truffé de réactions acidobasiques, c’est-à-dire qui mettent un jeu un transfert de proton.
L’autoprotolyse de l’eau
Proton qui en réalité ne se balade jamais seul en solution ! H+ est plus une idée qu’autre chose. En pratique, l’eau est une espèce ampholyte : elle se comporte à la fois comme un acide et une base. A ce titre, elle peut et céder et capter un proton, et a donc tendance à ne pas chercher bien loin son partenaire acidobasique. Plutôt que de s’échanger des protons avec un autre couple acide/base que les siens (H3O+/H2O et H2O/HO-), l’eau est le siège d’une autoprotolyse : H2O choppe un proton labile à une autre molécule d’eau, devenant alors H3O+. La molécule d’eau ainsi volée se retrouve dénuée d’un proton : elle devient HO-. En résumé :
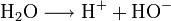
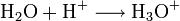
Bref, un proton perdu a vite fait d’être solvaté et de finir en H3O+ou HO- !
La constante d’équilibre de cette réaction intrinsèque, définie comme le produit des concentrations en ions oxonium (H3O+) et hydroxyde (HO-) est appelée produit ionique de l’eau. A 25°C, ce produit vaut 10-14, autant dire qu’il n’y a pas de quoi fouetter un chat ! Dans les faits, l’eau pure ne conduit donc pas le courant, étant donné le nombre impondérable d’ions (porteurs de charges en solution).
Application au potentiel hydrogène
Le potentiel hydrogène, ou pH, découle de ce que nous venons de voir. En effet, l’autoprotolyse de l’eau produit autant d’ions oxonium autant que d’ions hydroxyde. Connaissant le produit, on en déduit la teneur de l’eau en ions oxonium et hydroxyde de l’eau pure : 10-7 pour les deux !
Il se trouve que le pH se définit comme le cologarithme de la concentration en ions oxonium, soit -log(10-7)=log 10-7=7. Preuve est faite que le pH à neutralité, correspondant à l’eau pure, vaut 7 !
En deça, la solution est acide, au-dessus basique. Vous n’avez plus aucune raison d’acheter un shampoing neutre à pH 6 
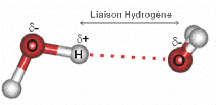
Schéma d’une liaison hydrogène. L’oxygène en rouge jouit d’une électronégativité bien supérieure à celle de l’hydrogène ; par conséquent il attire les électrons et se retrouve ainsi chargé négativement, au détriment de l’hydrogène qui devient électropositif. Une telle molécule d’eau s’associe avec une autre, l’hydrogène (+) de l’une étant attirée par l’oxygène (-) de l’autre (les contraires s’attirent !)
De la sorte, il se forme un filet invisible de molécules d’eau à la surface, assez puissant pour empêcher un objet léger de ne pas couler.
Si vous voulez tout savoir, l’eau se caractérise par un moment dipolaire permanent, puisque la molécule d’eau se définit par une répartition hétéroclite de charges électriques telles que le barycentre des charges positives ne coïncide pas avec celui des charges négatives. Résultat, à une molécule d’eau est associé un vecteur-résultante de l’attraction. La norme de ce vecteur s’exprime en debye, et le moment dipolaire de l’eau vaut 1.83 D : bien assez pour que les molécules d’eau s’attirent les unes les autres !
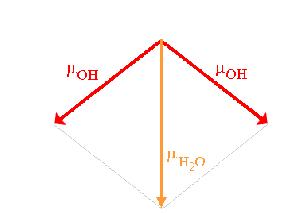
Sachez aussi qu’il existe des moments dipolaires induits par un champ électrique. L’électricité peut donc influer sur les phénomènes de tension superficielle ; si cela vous intéresse je vous renvoie vers un cours d’électromagnétisme des milieux matériels. Certains éléments sont ainsi sujets à la polarisation, on les appelles polarisables.
La rigidité des gouttes d’eau, justement, est due à cette attraction entre molécules. Il est touchant de voir une fourmi jouer avec une goutte ; cela révèle la texture en gros plan de ces agrégats de molécules d’eau que sont les gouttes :
La tension superficielle explique la formation des bulles de savon, ainsi que la coalescence des gouttes (tendance qu’elles ont à se réunir, comme attirées par une force mystérieuse). La tension superficielle est également primordiale en médecine : elle est cette force qui contribue à maintenir les vaisseaux ouverts, donc éviter le collapsus qui mène à la rupture d’anévrisme, et par voix de fait à la mort !
La surface de la bulle est entièrement en contact avec l’air : plus la surface de contact est grande, plus l’énergie fournie pour maintenir stable la bulle est importante ; donc plus la tension superficielle doit être élevée. Le liquide doit prendre la forme qui aura la surface la plus faible possible afin de minimiser l’énergie de surface : la forme géométrique qui assure une surface minimale est la sphère, d’où la forme quasi-sphérique des gouttes d’eau (et qui l’est plus ou moins selon la surface : verre ou cellophane) !
Aussi, tout écolier a déjà été confronté au ménisque en TP de chimie : l’eau remonte légèrement le long des parois d’une éprouvette, en raison des forces de tension superficielle.
De l’air emprisonné dans les bulles…
Aussi bien en médecine qu’en physique des matériaux, les forces de tension superficielle exercées à une interface solide-liquide font intervenir la loi de Laplace, qui stipule que la pression à l’intérieur d’une bulle est supérieure à la pression extérieure, ce afin de permettre que la bulle ne s’effondre pas sur elle-même : pour contrebalancer la pression extérieure, il s’exerce à l’intérieur une surpression. La différence de pression prend le nom de pression transmurale, et s’exerce perpendiculairement à la surface de la bulle, ou plus généralement de toute paroi.
Si cela paraît anecdotique pour une bulle, la pression transmurale est capitale en cardiologie, preuve qu’à dire que les choses servent à rien on s’y méprendrait… (voir un cours de mécanique des fluides : http://www.cofemer.fr/userfiles/MicAP3.pdf) La pression transmurale correspond ainsi à la différence entre la pression intravasculaire et extravasculaire. Elle a un effet sur la répartition du sang, donc la bonne vascularisation des organes.
Pour information, voici l’expression générale de la pression transmurale, différence de pression intérieure (Pb) /extérieure (Pa), où γ représente le coefficient de tension superficielle, et R1 et R2 les rayons de courbure de la surface. Dans le cas d’une bulle, il s’agit d’une sphère, donc (contrairement à un ballon de rugby) le rayon de courbure est le même en tout point, soit R1=R2=R.
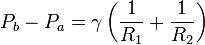
Ainsi, l’expression se simplifie :
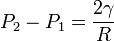
Or dans une bulle il existe deux interfaces : une interface air-liquide, et une interface liquide-air. La pression transmurale uniforme confère la sphéricité aux bulles ; eu égard à cette considération de double interface, en voici l’expression après multiplication par 2 :
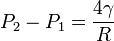
Chimériques bulles géantes
D’emblée on remarque que plus le rayon (R) augmente au dénominateur, plus la pression transmurale diminue. Or plus cette pression diminue, plus il devient difficile de lutter contre l’effondrement. Dites-vous bien que la pression transmurale agit comme des petits bonhommes qui pousseraient de leurs bras le film de savon afin de maintenir la bulle en bonne et due forme. Plus la surface est grande, plus le travail est difficile… Nous venons de démontrer qu’il est difficile, voire inenvisageable de créer des bulles géantes !

Rien n’est plus beau, mais aussi évanescent qu’une bulle de savon, en équilibre métastable : frôlez-là, et elle s’évanouit.
En médecine, c’est la même chose : le cœur doit assurer un débit suffisant pour maintenir l’artère ouverte. Un colapsus aortique est mortel, d’où la nécessité de traiter les patients atteints d’insuffisance cardiaque avec des vasodilatateurs. En particulier, les inhibiteurs de l’enzyme de conversion de l’angiotensine I (ECA) sont préconisés, en raison du redoutable effet vasoconstricteur de l’angiotensine II : il s’agit donc d’empêcher la formation d’angiotensine 2. Le captopril est le fer de lance de ces médicaments. Il fut isolé à partir du venin de serpent brésilien Bothrops jararaca, lequel (sans être boa constrictor !) provoque une vasoconstriction de ses victimes…
Je ne vous cache pas que la nature est plus futée que les bulles : pour palier à tout dysfonctionnement, on trouve dans la media (tunique externe) des artères élastiques des cellules rameuses, cellules musculaires ayant pour fonction d’aider à garder ouverte la lumière du vaisseau.
Les forces de tension superficielle expliquent également la capillarité (ou effet-buvard d’imprégnation par une tâche) : dans le cadre de la loi de Jurin, les liquides peuvent remonter dans un tube capillaire.
Les forces de Van der Waals
Comme souvent en sciences, on ne peut expliquer une chose sans recourir à d’autres concepts. Ainsi, les lézards défient la pesanteur en raison des forces de Van der Waals. Les pattes dont sont pourvus ces animaux intéressent au plus haut point les chercheurs en nanotechnologies en raison de leur adhérence extrême. A lire, un article de Pour la science : l’inusable adhésif des pattes du gecko.
Les forces de Van der Waals sont des interactions électrostatiques de plus faible intensité que les liaisons hydrogène, mais leur multitude et leur diversité (on distingue des forces de London, keesom, Debye) concoure à créer une attraction suffisante pour souder les molécules d’eau.

La rosée matinale sublime les plantes.

Ce pengő hongrois flotte, pourtant il est plus dense que l’eau !
Outre les impuretés exogènes, un cristal de glace peut servir de noyau de condensation et déstabiliser l’eau en surfusion.
Des travaux récents suggèrent également que la surfusion est un problème d’occupation géométrique de l’espace. A l’instar des pavages, certaines structures moléculaires s’autoorganisent afin de minimiser l’énergie ; or en vertu de la loi d’équipartition de l’énergie, les édifices les plus stables se répartissent l’énergie homogènement.
Aussi, dans la stabilité de certains édifices moléculaires plutôt que d’autres, il est question de coût entropique, notion éminemment difficile à expliquer sans faire appel à la thermodynamique. L’entropie est, en substance, la tendance d’un système au désordre. Ainsi des édifices élaborés (caténanes, micelles, complexes, cristaux, variétés alotropiques du carbone telles les nanotubes, le diamant, les fullerènes, le footballène et la lonsdaléite) s’agenceraient pour minimiser le coût entropique inhérent à certaines réactions.
. Ces propriétés fascinantes d’auto-agencement sont d’ailleurs à l’origine du vivant : la bicouche lipidique composant la membrane des cellules ne sont à la base rien d’autre qu’une micelle (à l’exception qu’en biologie les micelles prennent le nom de vésicules, et qu’elles sont renforcées de protéines telles les coatomères ou triskélions de clathrine, protection contre les enzymes gourmandes oblige !). En s’organisant de manière à éviter tout contact avec l’eau, les têtes hydrophobes (qui n’aiment pas l’eau) créent un cocon séparant le milieu extérieur d’un intérieur : la vie peut se développer, et les composés hydrophobes sont à l’origine même de l’homéostasie, notion capitale développée par Claude Bernard, fondateur de la médecine expérimentale, et qui consiste en le maintien du milieu intérieur, d’abord par la chimie et ensuite par des régulations cybernétiques faisant intervenir des hormones.
En se basant sur les vésicules naturelles, on peut d’ailleurs créer des cellules artificielles, du moins le contenant avec des éléments à se procurer au supermarché (le contenu, c’est une autre histoire, fruit de près de quatre milliards d’années d’évolution !) : http://www.futura-sciences.com/fr/news/t/biologie-3/d/la-recette-dune-membrane-cellulaire-artificielle-cest-facile_36320/
L’hypothèse selon laquelle la surfusion aurait une origine géométrique (les symétries sont incriminées), tend à être confirmée par de récentes expériences menées au synchrotron de Grenoble, avec la création d’or en surfusion. Cependant, le mécanisme de surfusion comporte encore de nombreuses zones d’ombre…
La surfusion vue par la thermodynamique
La thermodynamique est la branche de la physique qui s’occupe de ce genres de phénomènes, marqués par la chaleur. Cela tombe bien, car avec les tasses qui sautent à la figure, et l’eau qui se refroidit instantanément, il y a matière à se poser des questions !
Et tout cela n’est pas fou… Il se trouve que l’énergie libérée par la solidification (chaleur latente de fusion, encore appelée enthalpie de changement d’état) ne compense pas l’énergie dépensée pour créer l’interface solide-liquide. Le liquide continue donc à se refroidir sans solidifier, car bien que la température soit plus basse (ou plus haute) que la température critique, le fait de passer de l’état liquide à l’état solide (respectivement de l’état liquide à l’état gazeux) requiert de l’énergie.
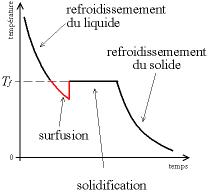
Cette courbe fait apparaître la plage de surfusion : au bout d’une température critique, le changement d’état est instantané, ce qui se traduit par une ligne verticale.
Energie critique
Un ester trinitrique du glycérol est connu sous le nom de nitroglycérine. La nitroglycérine est un composé métastable, c’est-à-dire qu’on peut le trimbaler à bout de main en marchant lentement. Pour peu qu’on accélère le pas, une friction est engendrée… et boom ! Une déflagration deux à trois fois supérieure à celle du TNT, avec un composé au départ pas plus dérangeant qu’un verre d’eau.
Quant à la nucléation d’une phase solide dans la phase liquide, en ce qui concerne la solidification instantanée donc, ceci est coûteux en terme d’énergie de l’interface solide-liquide. Pourtant, dès qu’un noyau assez grand a pu se former, ce coût de surface devient faible devant le gain en volume dû à l’énergie de fusion : la réaction en chaîne démarre, de même qu’un détonateur chimique est nécessaire pour amorcer une explosion nucléaire.
Finalement, la surfusion est un compromis : “d’accord les copines molécules, on peut rester encore liquide même s’il continue à faire froid, à condition que tout soit calme”. Toute transition de phase bouleverserait en effet l’état du système, ne rien faire est encore la meilleure solution pour s’économiser quand il fait chaud ! L’eau peut théoriquement être en surfusion jusqu’à -40°, mais à cette température l’expérience devient dangereuse à cause du froid. A moins de compter sur la caléfaction, autre phénomène contre-intuitif (dû au fait que la glace au contact des doigts beaucoup plus chauds se vaporise et constitue ainsi une couche protectrice atténuant le transfert thermique), à cette température c’est la nécrose des doigts assurée…
Dieu soit loué, on peut être sage et voir l’expérience en vidéo  Quoiqu’il n’y ait aucun danger à la réaliser sans aller trop bas dans les températures, c’est souvent un possible pour une raison bien simple : l’eau ne peut pas rester en surfusion au congélateur, car la plupart des congélateurs tremblent, or nous avons rabâché que la surfusion et les chocs ne font pas bon ménage !
Quoiqu’il n’y ait aucun danger à la réaliser sans aller trop bas dans les températures, c’est souvent un possible pour une raison bien simple : l’eau ne peut pas rester en surfusion au congélateur, car la plupart des congélateurs tremblent, or nous avons rabâché que la surfusion et les chocs ne font pas bon ménage !
Conclusion : il est difficile de garder l’eau en surfusion. Peut-être une virée scientifique à Picard s’impose-t-elle, afin de tester si leurs congélateurs professionnels tremblent moins…
La surfusion en littérature
La surfusion est connue depuis bien longtemps, et elle a même inspiré Jules Vernes, qui en parle dans son roman Hector Sarvadac, à propos de la solidification instantanée d’un bassin.
L’écrivain italien Curzio Malaparte raconte également ce phenomène ô combien surprenant, présumé survenu au siège de Léningrad en 1942 :
« Le troisième jour un énorme incendie se déclara dans la forêt de Raikkola. Hommes, chevaux et arbres emprisonnés dans le cercle de feu criaient d’une manière affreuse. (…) Fous de terreur, les chevaux de l’artillerie soviétique – il y en avait près de mille – se lancèrent dans la fournaise et échappèrent aux flammes et aux mitrailleuses. Beaucoup périrent dans les flammes, mais la plupart parvinrent à atteindre la rive du lac et se jetèrent dans l’eau. (…)
Le vent du Nord survint pendant la nuit (…) Le froid devint terrible. Soudainement, avec la sonorité particulière du verre se brisant, l’eau gela (…)
Le jour suivant, lorsque les premières patrouilles, les cheveux roussis, atteignirent la rive, un spectacle horrible et surprenant se présenta à eux. Le lac ressemblait à une vaste surface de marbre blanc sur laquelle auraient été déposées les têtes de centaines de chevaux. »
Et Kurt Vonnegut de développer l’idée de la solidification des océans dans le livre Le cerveau du chat, tant la surfusion est un phénomène mystérieux s’apparentant à la magie.
Enfin, dans les diagrammes de phase (par exemple pression en fonction de la température), il existe une zone où la matière se présente dans un état exotique appelé fluide supercritique. Cette transition vers l’état supercritique nécessite des conditions de pression et température extrêmes, en particulier elle se produit au sein du manteau terrestre, après passage d’un seuil thermodynamique (point critique).
Egalement, au point triple, la matière coexiste sous trois états : solide, liquide et gazeux ; et dans des conditions extrêmes, telles que dans le soleil, les étoiles, ou une bombe atomique, la matière passe sous forme de plasma, soupe d’électrons baignant avec des noyaux d’atomes…
Moralité : la science peut sauver la vie, et plutôt que de faire chauffer sa tisane au micro-ondes alors que les bouilloires ou thermistances sont faites pour ça, pensez physique des transitions de phase 
Si la surfusion vous plaît, il est une expérience hallucinante que vous pourrez pas reproduire chez vous, mais qui vaut la peine d’être connue : dans le cadre des travaux sur le froid extrême, les physiciens du vingtième siècle découvrirent deux phénomènes stupéfiants : la supraconductivité (ou lévitation), dont le graal est actuellement de la reproduire à haute température, ainsi que la superfluidité, propriété qu’ont les fluides refroidis à une température proche du zéro absolu de passer à travers la matière. L’hélium superfluide peut même jaillir du récipient : c’est l’effet fontaine.
Ci-dessous, illustration de la supraconductivité (absence totale de résistance électrique associée à un écrantage du champ magnétique) : le principe est celui du train à lévitation magnétique japonais (Maglev).
C’est ainsi que l’hélium refroidi à -270,98°C, liquide donc, se comporte comme un liquide fantôme : il passe à travers un récipient ; l’étrangeté de ce phénomène tenant à la délocalisation quantique des particules induite par le froid. A une température très basse, les gaz liquéfiés se trouvent en partie dans un état exotique de la matière, le condensat de Boze-Einstein, dont on sait désormais le produire en totalité (prix Nobel 1995 et 2001).
Pour clore, je dirai qu’il faut en sciences avoir un certain goût à remettre en question les appris élémentaires, car rien n’est aussi simple que ce qu’on apprend à l’école. De même qu’un médecin ausculte son patient sans poser un diagnostic illico, tout le monde devrait garder à l’esprit que la nature peut parfois surprendre !
Dans un prochain article, nous parlerons activité chimique, oxydoréduction, équation de Nernst, canaux ioniques, et transmission des potentiels d’action le long des nerfs… Nous verrons en quoi les réactions d’oxydoréduction, foisonnantes dans les mitochondries, sont à la base de la respiration ! Si vous le voulez bien, ça promet d’être passionnant 
