 Korlym (mifépristone) vient d'être approuvé par la Food and Drug Administration américaine pour contrôler des niveaux élevés de sucre dans le sang (hyperglycémie) chez les adultes atteints du syndrome de Cushing atteints de diabète de type 2 ou d'intolérance au glucose et non candidats à la chirurgie ou qui n'ont pas répondu à une chirurgie préalable.
Korlym (mifépristone) vient d'être approuvé par la Food and Drug Administration américaine pour contrôler des niveaux élevés de sucre dans le sang (hyperglycémie) chez les adultes atteints du syndrome de Cushing atteints de diabète de type 2 ou d'intolérance au glucose et non candidats à la chirurgie ou qui n'ont pas répondu à une chirurgie préalable.
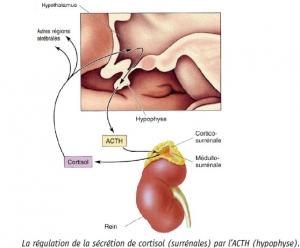
Avant cette approbation, aucun traitement médical n'était approuvé pour le traitement du syndrome endogène de Cushing, une maladie grave, rare, multisystémique et invalidante causée par la surproduction de cortisol (une hormone stéroïde qui augmente les niveaux de sucre dans le sang) par les glandes surrénales. Ce syndrome affecte les adultes âgés de 25 et 40. Son incidence est de l'ordre d'un nouveau cas par million de personnes et par an. 5.000 patients (aux Etats-Unis) seraient éligibles au traitement par Korlym.
Korlym avait déjà reçu la désignation de médicament orphelin par la FDA en 2007. Le médicament bloque la liaison du cortisol à son récepteur. Sans diminuer la production de cortisol, il réduit les effets du cortisol en excès, tel que des niveaux élevés de sucre dans le sang. Son innocuité et son efficacité ont été évaluées, chez les patients atteints du syndrome de Cushing par un essai clinique mené auprès de 50 patients.
Grâce à Korlym, les patients ont connu une amélioration significative du contrôle de leur glycémie et, pour certains, une amélioration des signes et symptômes cliniques rapportés. Korlym ne doit jamais être utilisé chez les femmes enceintes. Korlym est fabriqué par une biotech californienne, Corcept Therapeutics.
Source: FDA FDA approves Korlym for patients with endogenous Cushing's syndrome(Visuel “Cortisol” Orphanet) En savoir plus avec Orphanet- Vignette NIIDK)

