On retiendra les saisines de l'Afssaps et de la DGS, en vue d'établir la liste des dispositifs médicaux implantables à risque en France et un plan de refonte du système de vigilance, de ce communiqué du Ministère de Santé portant sur le rapport sur les prothèses mammaires Poly Implant Prothèse, publié au 1er février par le Ministère de la Santé. Pas vraiment de mea culpa des autorités sanitaires qui auront été abusées, tout comme les professionnels de santé par « une tromperie de grande ampleur organisée par la société PIP ».
Les ministres avaient demandé le 7 décembre 2011 au directeur général de la Santé et au directeur général de l'Afssaps, d'établir un état des lieux complet sur les contrôles effectués par les autorités sanitaires sur la société Poly Implant Prothèse depuis sa création, ainsi que sur les mesures mises en œuvre. Le directeur général de la Santé et le directeur général de l'Afssaps ont remis ce rapport mercredi 1er février au Ministère de la Santé.
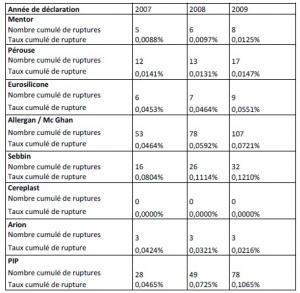
- Avril 1995 : Une lettre recommandée à la société PIP fait état de la survenue de plusieurs cas de rupture de prothèse, sans que ces événements graves aient été notifiés au ministre de la santé.
- Mai 1996 : arrêté portant suspension de mise sur le marché des prothèses mammaires internes dont le produit de remplissage est autre que du sérum physiologique (pour mémoire)
- Août 1996 : saisine de la DRASS PACA par la DH pour une demande d'enquête concernant les conditions de la mise sur le marché des prothèses mammaires internes par la société PIP, saisine du procureur du Tribunal de grande instance de Toulon par la DH puis, en septembre, saisine de la DGCCRF, dénonciation anonyme…En synthèses, les autorités sanitaires étaient informées dès 1995 des problèmes liés aux implants mammaires PIP.
Le rapport pointe donc les faiblesses des systèmes de contrôle et de vigilance et le Ministère annonce un renforcement de la vigilance exercée par l'Afssaps avec des contrôles plus nombreux et inopinés, tant sur les lieux de production que dans les établissements de santé. Le Ministère confirme son souhait d'un renforcement au niveau européen de l'évaluation pour la mise sur le marché des dispositifs médicaux, des modalités d'inspection et des échanges entre autorités compétentes.
2 saisines ont été formulées par le Ministère, pour mars 2012,
- une saisine de l'Afssaps, en vue d'établir la liste des dispositifs médicaux implantables à risque et le programme d'inspection envisagé par l'Agence pour 2012,
- une saisine de la DGS et de l'Afssaps pour présenter des propositions de refonte du système de vigilance.
Par ailleurs, d'ici mi-mars, le Ministère de la Santé devrait publier un nouveau rapport, plus global, sur l'état des lieux et les perspectives d'utilisation des prothèses mammaires en silicone, dix ans après la levée du moratoire en France.
Sur les dernières recommandations aux patientes, le rapport conclut que « la non-conformité, le défaut de qualité, la variabilité d'un lot à l'autre et le pouvoir irritant sont quatre éléments qui justifient à eux seuls, à titre de précaution, l'explantation des prothèses et la surveillance des femmes implantées ».
Dans un contexte de préparation à l'échelle européenne d'une nouvelle réglementation pour les dispositifs médicaux invasifs, des craintes exprimées sur les dispositifs de comblement des rides, certains types de prothèses de hanche et plus récemment sur les implants mammaires à revêtement en mousse de polyurétane, les autorités sanitaires françaises
Source : Ministère de la Santé « ÉTAT DES LIEUX DES CONTRÔLES OPÉRÉS PAR LES AUTORITÉS SANITAIRES SUR LA SOCIÉTÉ POLY IMPLANT PROTHÈSE »

Accéder aux dernières actualités sur les implants

