PALUDISME: DÉCOUVERTE capitale d’une protéine qui bloque la survie du parasite – Journal of Biological Chemistry
Publié le 07 janvier 2012 par Santelog
@santelog
 Ce laboratoire de biologie à l'Université de Washington a cracké la structure et la fonction d'une protéine qui joue un rôle clé dans la survie de Plasmodium Falciparum, le parasite du paludisme responsable de plus de 650.000 décès chaque année. Parce que la protéine est est présente chez le parasite, mais pas chez l'Homme, c'est une cible idéale pour un médicament antipaludéen. Cette découverte primordiale, est publiée comme article de la semaine dans l'édition du 6 janvier du Journal of Biological Chemistry (JBC) et dans le bulletin de l'American Society fior Biochemistry and Molecular Biology (ASBMB).
Ce laboratoire de biologie à l'Université de Washington a cracké la structure et la fonction d'une protéine qui joue un rôle clé dans la survie de Plasmodium Falciparum, le parasite du paludisme responsable de plus de 650.000 décès chaque année. Parce que la protéine est est présente chez le parasite, mais pas chez l'Homme, c'est une cible idéale pour un médicament antipaludéen. Cette découverte primordiale, est publiée comme article de la semaine dans l'édition du 6 janvier du Journal of Biological Chemistry (JBC) et dans le bulletin de l'American Society fior Biochemistry and Molecular Biology (ASBMB).
Cette protéine est une enzyme que Plasmodium falciparum, le protozoaire qui provoque la forme la plus mortelle du paludisme, utilise pour fabriquer sa membrane cellulaire. Le parasite ne peut donc pas survivre sans cette enzyme, mais même si cette enzyme a de nombreux sosies dans d'autres organismes. Toutes ces caractéristiques font de l'enzyme une cible thérapeutique idéale.
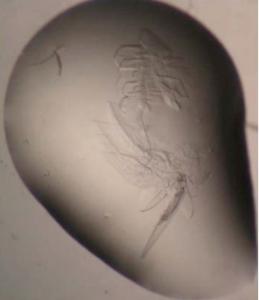
Cristalliser les protéines (visuel de gauche): Les auteurs rappellent qu'« au départ », Plasmodium falciparum se glisse dans une cellule de l'intestin du moustique, son hôte primaire. Bien que 5 espèces différentes de Plasmodium puissent entraîner le paludisme, Plasmodium falciparum est responsable de sa forme la plus grave. Le Pr. Joseph Jez, professeur agrégé de biologie étudie depuis 6 ans la structure de la protéine. «Notre laboratoire est capable de cristalliser les protéines de sorte que nous pouvons les étudier en trois dimensions. En connaissant la structure d'une protéine, il est plus facile de concevoir des produits chimiques qui ciblent son site d'activité pour l'arrêter".
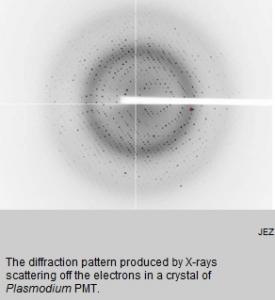
L'aboutissement d'années de recherche : Les chercheurs ont commencé par cristalliser l'enzyme de C. elegans, un vers rond microscopique, puis de s'attaquer à d'autres protéines d'autres organismes. «Même si les protéines sont ressemblantes, chacune présente une séquence d'acides aminés différents et se comporte différemment dans les cristallisations", explique le Pr. Jez. Les chercheurs ont travaillé ainsi sur les protéines de Plasmodium falciparum et ont obtenu 4 types de cristaux empilés les uns sur les autres et aussi fins que du papier puis réussi à diffracter un cristal de Plasmodium (visuel de droite) qui a livré son secret,une carte de densité électronique en 3 D. A partir de là, les chercheurs ont pu reconstruire la structure correspondant à la séquence d'acides aminés de la protéine et comprendre comment l'enzyme fonctionne : Cette enzyme, PMT, tente de joindre deux molécules. Elle possède un couvercle qui s'ouvre et se referme…
La protéine PMT est une cible idéale. Lorsque PMT est désactivée, le parasite ne peut pas fabriquer ses membranes cellulaires et il meurt. Bien que le processus d'identification de composés qui cibleraient PMT en est à ses débuts, quelques composés anti-parasitaires déjà connus seraient capables d'ores et déjà de bloquer PMT.
Sources: Washington University in Saint Louis “Scientists characterize protein essential to survival of malaria parasite” et JCB doi: 10.1074/jbc.M111.315267 “Structure and Reaction Mechanism of Phosphoethanolamine Methyltransferase from the Malaria Parasite Plasmodium falciparum- AN ANTIPARASITIC DRUG TARGET”
Accéder aux dernières actus sur le Paludisme
 Ce laboratoire de biologie à l'Université de Washington a cracké la structure et la fonction d'une protéine qui joue un rôle clé dans la survie de Plasmodium Falciparum, le parasite du paludisme responsable de plus de 650.000 décès chaque année. Parce que la protéine est est présente chez le parasite, mais pas chez l'Homme, c'est une cible idéale pour un médicament antipaludéen. Cette découverte primordiale, est publiée comme article de la semaine dans l'édition du 6 janvier du Journal of Biological Chemistry (JBC) et dans le bulletin de l'American Society fior Biochemistry and Molecular Biology (ASBMB).
Ce laboratoire de biologie à l'Université de Washington a cracké la structure et la fonction d'une protéine qui joue un rôle clé dans la survie de Plasmodium Falciparum, le parasite du paludisme responsable de plus de 650.000 décès chaque année. Parce que la protéine est est présente chez le parasite, mais pas chez l'Homme, c'est une cible idéale pour un médicament antipaludéen. Cette découverte primordiale, est publiée comme article de la semaine dans l'édition du 6 janvier du Journal of Biological Chemistry (JBC) et dans le bulletin de l'American Society fior Biochemistry and Molecular Biology (ASBMB).