Que va devenir notre corps après la mort ? Un tas de poussières ou de cendres rien d'autre...oui mais... Savez vous qu'une société néerlandaire propose de transformer les cendres issues de la crémation en pierre précieuse, en non des moindres, en diamant ! De quoi briller de mille feux, de façon éternelle et de défier le temps. Certains sont tentés par l'expérience (en France il semblerait que ce ne soit pas encore autorisé).
Avant s'intéresser au procédé, revenons sur ce qu'est le diamant.
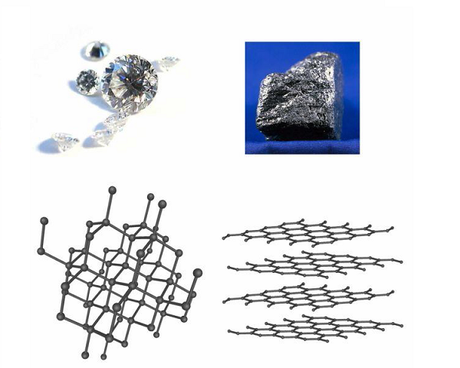
Le diamant naturel
A l'évocation de ce mot, deux propriétés nous viennent à l'esprit : la brillance et la dureté. Alors pourquoi ?
D'un point de chimique, le diamant n'est autre que du carbone pur, à l'exception de quelques inclusions d'autres éléments chimiques près qui d'ailleurs en disent long sur les circonstances de sa génèse.

Le carbone est un élément chimique qui compose la plupart des êtres vivants. Un des éléments les plus abondants sur terre, et présent depuis sa formation. Il possède 6 électrons, dont 4 sur la couche externe, dite de Valence, c'est à dire la couche qui va chercher à associer ses électrons avec ceux d'autres atomes, afin de la saturer : cette mise en commun de doublets d'electrons entre deux atomes s'appelle une liaison chimique (dite covalente, et de nature "très forte").
Dans le cas du carbone, il y a donc possibilité de 4 liaisons covalentes pour assurer la stabilité de l'élément. Le carbone s'associe avec un grand nombre d'atomes, dont en grande majorité l'oxygène (la molécule de CO2), l'hydrogène (ex: famille des hydrocarbures) mais aussi l'azote ou le soufre ... par le biais de 4 liaisons simples (cas des alcanes, sous-famille des hydrocarbures), ou de deux liaisons doubles (cas du CO2), de liaisons triples ou d'un mélange de tout cela pour des structures plus complexes.
Lorsque les atomes de carbone s'associent uniquement entre eux, on parle de graphite (notre mine de crayon de bois) ou de diamant (en fait il y a encoe d'autres composés dont nous ne parlerons pas ici). Ce sont toutes les deux des structures cristallisées (c'est à dire que les atomes s'organisent dans l'espace en une structure parfaitement ordonnée sous l'effet d'équilibre entre les forces électriques) au contraire de la structure amorphe (pas organisée du tout).
Selon la façon dont les atomes s'organisent dans l'espace pour assurer la saturation de leur couche électronique de périphérie, on va obtenir soit le graphite (de structure hexagonale) soit le diamant (de structure cubique). De cette structure vont découler les propriétés radicalement opposées des deux matériaux. Explications...
Graphite:
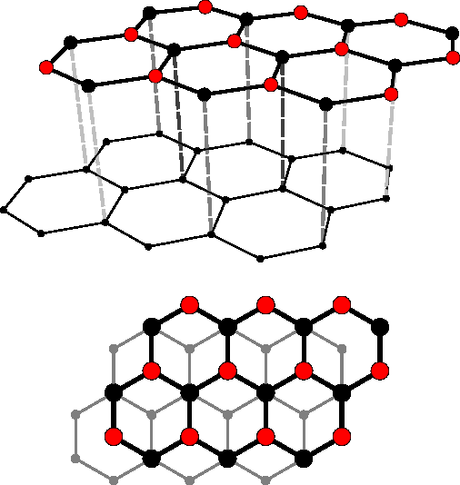
POur le graphite, chaque atome de carbone s'entoure de 3 voisins (se plaçant au sommet d'un triangle) avec qui il forme des liaisons covalentes donc "fortes" : tout cela s'organise dans un espace plan, sous forme d'une structure hexagonale. Cet espace plan se nomme "feuillet". Donc si on fait le compte, on n'a que 3 electrons sur les 4 qui ont trouvé un compagnon dans le cadre de liaisons fortes. Pour le 4e, et bien il s'agit d'un electron qui n'est attaché à aucun atome bien particulier et qui est libre de circuler entre plusieurs atomes (on appelle cela un électron délocalisé).
POur l'instant, on n'a décrit qu'un feuillet, c'est-à-dire un plan. Le graphite est en fait une superposition de ces feuillets, et les forces qui les relient les uns avec les autres sont des forces d'attraction dites de Van der Waals qui ne sont pas des liaisons chimiques mais des liaisons faibles (dues à l'attraction électrostique entre un atome et un autre d'un feuillet parallèle). La distance entre atomes d'une même couche est de 0.142 nm et celle qui sépare les couches est de 0.335 nm.
Cette struture explique les propriétés du graphite :
1- Matériau conducteur de l'électricité : à cause de la présence d'électrons délocalisés qui peuvent voyager facilement.
2- Propriétés anisotropes, c'est-à-dire différentes selon la direction. Ex: le graphite est conducteur dans le plan des feuillets; mais 200 fois moins bon conducteur dans la direction perpendiculaire aux feuillets (les électrons ne sautent pas d'un feuillet à l'autre).
3- Matériau très friable : ceci s'explique par les liaisons de faible intensité qui relient les feuillets et qui se cassent facilement.
4- Sa couleur foncée. C'est encore une fois la structure cristalline qui va dicter la façon dont la lumière va se comporter au sein d'un objet. Soit elle s'y refléchit, s'y refracte ou est absorbée. Le graphite est noir à cause de la grande délocalisation des électrons dans le réseau qui fait que la lumière y est absorbée.
NB: Notons qu'un simple feuillet de graphite porte le nom de graphène, un matériau dont nous reparlerons.
Le diamant:
Dans le diamant, chaque atome de carbone est fortement lié à (non plus 3 mais) 4 atomes voisins situés au sommet d'un tétraèdre (prisme triangulaire). On a la formation d'une structure cubique avec une distance entre atomes de 0.142 nm. Cela confère à l'ensemble une structure tridimensionnelle dont la cohésion est assurée par uniquement des liaisons covalentes (donc fortes).
Ce réseau 3 D de liaisons covalentes (comprenant un plus grand nombre d'atomes de carbones par unité de volume que dans le graphite), explique donc la très grande dureté de celui-ci et sa température de fusion élevée (beaucoup de liaisons fortes à casser).
L'absence d'électrons délocalisés, explique sa propriété d'isolant électrique.
Enfin, cette structure cubique permet une importante réfraction de la lumière et la lumière part dans toutes les directions, c'est ce qui fait la brillance et l'éclat du diamant.
Conditions de formations pour les deux structures :
On s'en doute, ce sont les paramètres température et pression qui conditionnent la structure cristallographique adoptée par les atomes de carbone.
Afin de former ce réseau 3D si dense pour le diamant, de très hautes pressions (entre 4 et 6 GPa - soit 40000 fois la pression atmosphérique) et hautes températures (vers 3000°C) sont requises. Du temps aussi, car la cristallisation est lente ce qui joue sur la taille des cristaux. Ces conditions de température et pression sont réunies à de grandes profondeurs dans le manteau terrestre (200 km environ). Le diamant s'est formé à partir du carbone présent dans le manteau (issus de carbonates) depuis la formation de la terre ou du carbone organique (végétaux) enfoui très profondément par le jeu des mouvements des plaques tectoniques.
LE diamant contient bien sûr des impuretés dont l'azote (une classification des diamants repose sur la teneur en impuretés)
Le graphite naturel lui se forme à des pressions basses et des températures moyennes (autour de1500 °C). Le graphite se trouve dans des roches métamorphiques, et est issu du de la transformation de composés carbonés sédimentaires.
POur synthétiser le diamant, le premier procédé (et aussi le plus connu) part du graphite et reconstitue les conditions présentes au niveau du manteau terrestre. C'est un procédé couteux nécessitant de fortes températures et pressions car il faut casser la structure du graphite et rapprocher les atomes (feuillets plus écartés que les distances interatomiques dans le diamant). Notons que d'autres conditions importantes sont aussi à réunir pour obtenir la transformation.
Le diamant à partir de cendres de défunt :
La crémation d'un corps se fait à une température de 850°C avec apport d'oxygène pour favoriser la combustion. Les cendres ne sont bien sûr pas transformables telle quelles. Il faut dans un premier temps extraire le carbone (car une combustion n'est jamais 100% efficace). Celui-ci est dans une première étape transformé en graphite puis en diamant par le procédé haute pression, haute température.
Voilà de quoi finir, de façon éternelle !
Pour en savoir plus :
http://fr.wikipedia.org/wiki/Graphite
http://fr.wikipedia.org/wiki/Diamant
http://fr.wikipedia.org/wiki/Carbone
http://en.wikipedia.org/wiki/LifeGem
http://fr.wikipedia.org/wiki/Cr%C3%A9mation
http://www.lenntech.fr/francais/data-perio/taux-elements-corps-humain.htm

