 Une molécule destinée à traiter l'hyperactivité et autres troubles du déficit de l'attention (TDAH) et prescrite à des millions d'enfants américains fait grand bruit aux Etats-Unis. Il s'agit de la Ritaline accusée d'avoir l'effet indésirable d'augmenter le risque d'événements cardiovasculaires graves. Mais cette très large étude de cohorte, publiée dans l'édition en ligne du 1er novembre du New England Journal of Medicine va rassurer les très nombreux parents qui font traiter leurs enfants. Elle conclut en effet à l'absence d'augmentation du risque d'événement cardiovasculaire, que ce soit chez les utilisateurs passés ou actuels.
Une molécule destinée à traiter l'hyperactivité et autres troubles du déficit de l'attention (TDAH) et prescrite à des millions d'enfants américains fait grand bruit aux Etats-Unis. Il s'agit de la Ritaline accusée d'avoir l'effet indésirable d'augmenter le risque d'événements cardiovasculaires graves. Mais cette très large étude de cohorte, publiée dans l'édition en ligne du 1er novembre du New England Journal of Medicine va rassurer les très nombreux parents qui font traiter leurs enfants. Elle conclut en effet à l'absence d'augmentation du risque d'événement cardiovasculaire, que ce soit chez les utilisateurs passés ou actuels.
Ces chercheurs américains ont mené une étude rétrospective de cohorte en analysant les données de 1.200.438 enfants et jeunes adultes âgés de 2 à 24 ans soit sur 2.579.104 personnes-années de suivi, dont 373.667 personnes-années d'utilisation actuelle de ces médicaments pour les TDAH. Ils ont identifié les événements cardiovasculaires graves (mort cardiaque subite, infarctus aigu du myocarde et accident vasculaire cérébral) à partir des dossiers médicaux des participants. Ils ont ensuite pu estimer le risque relatif (RR) chez les utilisateurs du médicament, comparativement aux non-utilisateurs.
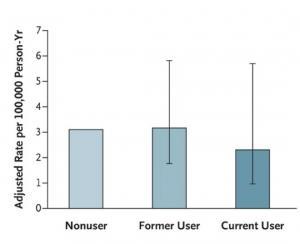
81 événements cardiovasculaires graves ont été identifiés durant le suivi de la cohorte soit un taux de 3,1/ 100.000 personnes-années. Les utilisateurs actuels de traitement pour le TDAH ne sont pas à risque accru d'incidents cardiovasculaires graves (RR : 0.75 IC : 95% de 0,31 à 1,85). Le risque n'apparaît pas augmenté non plus pour les utilisateurs actuels par rapport aux anciens utilisateurs (RR : 0.70 IC : 95%, de 0,29 à 1,72). Enfin, cette large étude ne montre aucune association significative entre l'utilisation d'un médicament pour le TDAH et une augmentation du risque cardiovasculaire.
Cette vaste étude, financée par l'Agence américaine pour la Recherche de la qualité des soins de santé et par la Food and Drug Administration (FDA) n'a donc trouvé aucune preuve que l'utilisation actuelle d'un médicament pour le TDAH soit associée à un risque accru d'événements cardiovasculaires graves.
La Ritaline (méthylphénidate) a été mise sur le marché en 1995 en France, avec 4 spécialités autorisées (Ritaline®, Concerta®, Quasym®, Méthylphénidate Rubio®). Début 2009, l'agence européenne du médicament (EMA) a émis de nouvelles recommandations concernant la prise en charge des patients devant être traités, ou déjà traités, avec du méthylphénidate (Ritaline) recommandant que les anomalies de la tension artérielle ou de la fréquence cardiaque soient recherchés avant la mise sous traitement. Mais l'EMA n'avait alors conclu à aucune restriction d'utilisation de la Ritaline. Il y a quelques mois, un comité de sécurité de la FDA avait demandé une modification de la notice de la Ritaline mettant en garde contre ses effets secondaires, une précédente étude, publiée dans le même NEJM, ayant analysé 25 cas d'enfants et d'adultes frappés de mort subite et ayant pris des médicaments à base de Ritaline. La Ritaline pourrait également être responsable d'hallucinations. Cette molécule est aujourd'hui prescrite à des millions d'enfants américains.
Source: NEJM November 1, 2011 DOI: 10.1056/NEJMoa1110212)« ADHD Drugs and Serious Cardiovascular Events in Children and Young Adults”


