 Depuis le 7 septembre, en pleines révélations dans l'affaire Mediator, voilà de nouveaux chefs d'accusation qui fleurissent dans les médias, sur un autre médicament du laboratoire Servier, Protelos®, indiqué dans le traitement de l'ostéoporose. Figurant sur la liste des médicaments sous surveillance renforcée, aux effets indésirables déjà bien connus, dont, en 2007, des syndromes « DREES » ayant conduit au décès de deux patients, le Protelos® est bien sous réévaluation de l'Afssaps. Mais simple réévaluation ou rapport sur manquements à la réglementation au risque d'attenter à la Santé publique, comme le révèle Libération ? Point sur le
Depuis le 7 septembre, en pleines révélations dans l'affaire Mediator, voilà de nouveaux chefs d'accusation qui fleurissent dans les médias, sur un autre médicament du laboratoire Servier, Protelos®, indiqué dans le traitement de l'ostéoporose. Figurant sur la liste des médicaments sous surveillance renforcée, aux effets indésirables déjà bien connus, dont, en 2007, des syndromes « DREES » ayant conduit au décès de deux patients, le Protelos® est bien sous réévaluation de l'Afssaps. Mais simple réévaluation ou rapport sur manquements à la réglementation au risque d'attenter à la Santé publique, comme le révèle Libération ? Point sur le
Protelos, (ranélate de strontium) est médicament indiqué dans le traitement de l'ostéoporose post-ménopausique pour réduire le risque de fractures osseuses. Il bénéficie d'une autorisation de mise sur le marché européenne depuis 2004. Il est commercialisé en France par les laboratoires Servier depuis janvier 2006. Le nombre de patients traités pendant un an est estimé à 570.000 dans l'Union européenne. Protelos® fait partie des médicaments faisant l'objet d'une surveillance renforcée de l'Afssaps est aujourd'hui l'objet, tout comme le Vastarel®, l'objet d'une réévaluation en cours.
En 2007, 16 cas de réactions allergiques graves (syndrome DRESS – Drug Rash with Eosinophilia and Systemic Symptoms), dont 13 en France, avaient été rapportés chez des patients traités par Protelos®. Dans la majorité des cas, l'évolution avait été favorable à l'arrêt du Protelos®, et après instauration d'une corticothérapie mais dans 2 cas, ces effets indésirables avaient conduit au décès du patient. Le syndrome DRESS est une réaction allergique grave, sous la forme d'une éruption cutanée souvent accompagnée de fièvre, entraînant l'atteinte d'un ou plusieurs organes, notamment le foie et le rein. L'Afssaps avait donc lancé une alerte en 2007 conduisant l'Agence européenne du médicament à ajouter une nouvelle mise en garde dans le résumé des caractéristiques du produit (RCP). Néanmoins, en 2009, L'AMM avait été renouvelée par l'EMA.
La principe actif de Protelos, le ranélate de strontium, agit sur la structure osseuse. Une fois dans l'intestin, le ranélate de strontium libère du strontium, qui est absorbé dans l'os. Le mécanisme exact du strontium dans l'ostéoporose n'est pas complètement compris, mais il est connu pour stimuler la formation osseuse et diminuer la résorption osseuse.
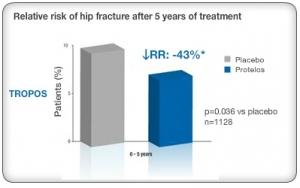
Dans la première étude, Protelos a réduit de 41% le risque sur 3 ans de nouvelle fracture de la colonne vertébrale. Les résultats de la seconde étude se sont avérés insuffisants, seuls, pour démontrer le bénéfice de Protelos dans la prévention des fractures osseuses. Mais l'Agence européenne du médicament précise que combinés, les résultats des deux études montrent un risque de fracture osseuse réduit avec Protelos.
Des risques bien connus déjà associés à Protelos : Les effets secondaires les plus communs avec Protelos (observés chez 1 à 10 patients sur 100) sont des céphalées, troubles de la conscience (évanouissement), perte de mémoire, nausées, diarrhées, selles molles, dermatite et eczéma, la thromboembolie veineuse et l'augmentation des niveaux de créatine kinase dans les muscles. Auxquels s'ajoute le risque de syndrome DRESS ou de réaction allergique sévère.
Que reproche-t-on aujourd'hui au laboratoire Servier? Selon le journal Libération du 7 septembre, un rapport de l'EMA concluerait que Servier a caché aux autorités de santé des cas d'effets secondaires du Protelos. Réalisé par l'Afssaps, qui confirme la réévaluation en cours, à la demande de l'EMA, le rapport indiquerait huit écarts majeurs et deux écarts critiques vis-à-vis de la réglementation, dont certains pourraient affecter la sécurité ou le bien-être des patients voire représenter « un risque potentiel pour la santé publique'", précise Libération. Serait également reprochée au laboratoire « l'absence de procédure structurée pour assurer une détection fiable des signaux de sécurité", impliquant que Servier n'aurait pas déclaré aux autorités des cas graves susceptibles de remettre en cause le médicament.
Quoiqu'il en soit, cette activité médiatique autour du Protelos ne pourra manquer d'inciter les cas d'effets secondaires « dissimulés » à se faire connaître et d'apporter à la société sa propre réponse.
Source: Afssaps Protelos EMA European Medicines Agency recommends changes in the product information for Protelos/Osseor due to the risk of severe hypersensitivity reactions (Visuels Servier UK)

