Découvreurs et définition de la couche d'ozone
Découvreurs
Léon TEISSENREC de BORT met en évidence en 1902 le rôle de la couche d'ozone qui absorbe le rayonnement solaire (en fait les ultraviolets).En 1974 deux scientifiques américains : Mario MOLINA et F. SHERWOOD ROWLAND formulent pour la première fois la théorie de l’appauvrissement de la couche d'ozone sous l'impact des ChloroFluoroCarbones (CFC), apparus en 1938. Et, J. FARMAN du British Antarctica Survey (BAS) annonce en 1985 qu'un "trou" temporaire mais important (jusqu'à 50% de pertes) apparaît chaque printemps dans la couche d'ozone au dessus de l'Antarctique depuis 1979 et se résorbe au début de l'automne.
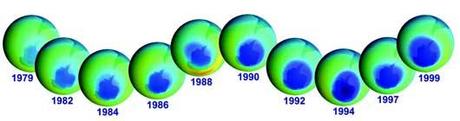
Evolution du trou dans la couche d'ozone depuis 1979. On constate que sa taille a augmenté régulièrement
Crédit : The Earth Observing System (NASA)
Qu'est-ce que l'ozone ?
L'ozone (O3) est une forme chimique particulière de l'oxygène, très instable et réactive.L'ozone est notamment généré par le bombardement de la molécule oxygène stable O2 par les utraviolets (UV). Condition indispensable : la présence d'oxygène qui a été produit en grande quantité avec la multiplication de micro-organismes photosynthétiques au Précambrien.
La couche d'ozone représente schématiquement la partie de l'atmosphère où sa concentration est la plus élevée. Ainsi, l'ozone est davantage présent à une distance du sol comprise entre 15 et 40 km (plus fortement vers 35 km) avec une concentration voisine de 8 ppmv, dans la couche appelée stratosphère. D'où l'appelation d'ozone stratosphérique à ne pas confondre avec l'ozone troposphérique induit en grande partie par la circulation automobile et qui irrite notamment les yeux et les voies respiratoires.
A cette altitude, la teneur en ozone résulte d'un équilibre entre formation et destruction sous la dépendance de l'activité solaire, de la température, de la présence d'autres substances chimiques.
En absorbant ensuite les UV, l'ozone contribue à réchauffer la statosphère. la formation de l'ozone est plus importante au dessus des tropiques puis gagne les pôles via la circulation des masses d'air. Cependant, il accuse une faible concentration de quelques parties par million au plus.
On parle de "trou" dans la couche d'ozone lorsque la valeur de la colonne intégrée en ozone est inférieure à 220 unités Dobson (la valeur normale étant 300 unités Dobson environ). Les unités Dobson expriment la totalité de l'ozone dans une colone qui part du sol et traverse toute l'atmosphère.
Le danger des rayons ultraviolets
La couche d'ozone est essentielle à la vie sur terre car elle la protège des rayonnements ultraviolets nocifs émis par le soleil. En effet, les UV dont la longueur d'onde est inférieure à 0,4 µm sont absorbés par l'ozone entre 0,24 et 0,3 µm.Il existe différents types de rayons UV regroupés en trois grandes classes : les rayons UV-C, les rayons UV-B et les rayons UV-A.
L’impact des UV sur les organismes vivants dépend de la longue longueur d’onde de ces rayons : plus cette longueur d’onde est courte, plus le danger est grand. Les rayons UV-C sont ainsi les plus dangereux de la gamme. Heureusement, ils sont arrêtés presque en totalité par la couche d’ozone. Or, cette couche protectrice s'est amincie dangereusement, particulièrement à une altitude comprise entre 14 et 20km.
Le 15 mars 1988, la NASA diffuse un rapport mené par une centaine de chercheurs dans le monde : la concentration en ozone stratosphérique a diminué en moyenne de 1,7 à 3% dans l'hémisphère nord entre 1969 et 1986 malgré les variations naturelles constatées de 15 à 20%. De surcroît, le rayonnement moyen mondial des UV-B au niveau de la surface terrestre s'est élevé de 10 % entre 1986 et 1996.
La dégradation de la couche d'ozone implique une moindre filtration des rayons ultraviolets les plus nocifs et une élévation des risques pour la vie terrestre :
- brûlures superficielles, conjonctivites, cataractes
- augmentation des cancers et viellissement de la peau
- maladies du système immunitaire
- réduction de la photosynthèse : diminution des rendements et de la qualité des cultures, disparition du plancton, premier maillon des chaînes alimentaires aquatiques...
- accélèrent la génération du smog photochimique, stimulant ainsi la production de l’ozone troposphérique qui est nocif
- diminuent "la durée de vie" de certains matériaux inorganiques comme les peintures et plastiques.
Évolutions récentes du trou
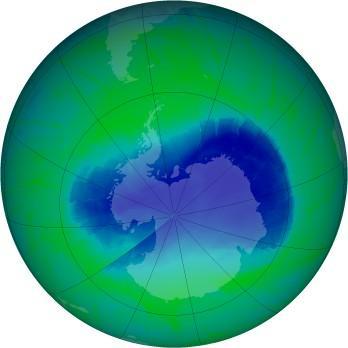
 Le trou dans la couche d'ozone, au dessus de l'Antarctique (au 03/12/2010)
Le trou dans la couche d'ozone, au dessus de l'Antarctique (au 03/12/2010)Crédit : NASA, 03/12/2010Les données pour l'Europe montrent des baisses de 5,4% par décennie depuis les années 80 en hiver et au printemps, avec une tendance à l'amélioration sur la période 1995-2000.
En 2000, 2001 et 2003, le trou dans la couche d'ozone a atteint une superficie jamais observée avant 2000, alors que celui de 2002 était le plus petit qui ait été observé depuis 1998. En effet, à la fin de l'été 2003, le trou a de nouveau atteint un record de superficie... Pour diminuer rapidement durant le mois d'octobre.
Selon l'Organisation Météorologique Mondiale ces "fluctuations aussi marquées sont dues aux variations interannuelles des conditions météorologiques régnant dans la stratosphère et non à la quantité totale de susbstances destructrices d'ozone dans cette couche de l'atmosphère." (OMM, 2004)
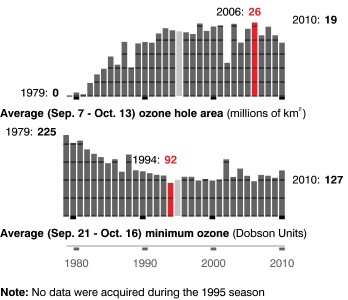 Evolution de l'étendue du "trou dans la couche d'ozone" au-dessus du pôle Sud, en millions de km2 et en unités Dobson
Evolution de l'étendue du "trou dans la couche d'ozone" au-dessus du pôle Sud, en millions de km2 et en unités Dobson Crédit : NASA, 12/2010
Les causes de cette destruction
Suite aux travaux de l'expédition scientifique de 1986 en Antarctique, Susan SALOMON puis James ANDERSON démontrent que les teneurs en chlore sont nettement supérieures aux "normales" dans les régions les plus affectées par la disparition de l'ozone.Paul CRUTZEN, Mario MOLINAS et Frank SHERWOOD établissent ensuite que les responsables sont des molécules chimiques produites par l'homme : les ChloroFluoroCarbones (CFC) et les halons.
Ces composés très stables montent lentement vers la stratosphère où ils catalysent la destruction de l'ozone. En effet, au contact des UV, ces gaz libèrent leur chlore par photolyse. De plus, les cristaux de glace présents dans les nuages d'altitude transforment les composés chlorés de l'atmosphère en chlore actif susceptible de détruire l'ozone.
Comme ces molécules chimiques introduites par les activités humaines persistent longtemps, leur action n'est neutralisée qu'après des dizaines d'années En effet, une molécule de CFC met environ 25 ans avant d'atteindre la stratosphère. Leur concentration ne diminuera que très lentement même lorsqu'ils seront bannis de toute utilisation et production.
Ozone... Quelle évolution depuis 30 ans? par CNES
Le temps de vie dans l’atmosphère des chlorofluorocarbones peut dépasser 100 ans. Ils sont à l'origine de la destruction de l'ozone stratosphérique. Comment le phénomène a-t-il évolué depuis 30 ans? Les réponses avec Carole Deniel, responsable des programmes en chimie de l'atmosphère au CNES.
Avec l'aimable autorisation du CNES
Les composés chimiques responsables
Les ChloroFluoroCarbones (CFC) sont des molécules composées de carbone, de fluor et de chlore.Ces molécules furent utilisées (notamment en remplacement d'hydrocarbures inflammables) car elles restent très stables et ne présentent donc aucune toxicité chimique pour l'homme. Leurs propriétés physico-chimiques très intéressantes expliquent pourquoi on les a utilisées très largement dans un grand nombre de processus industriels et de produits de consommation :
- liquide de refroidissement dans les systèmes frigorifiques (domestiques, industriels et commerciaux) et les conditionnements d'air
- solvant et gaz propulseur dans les aérosols
- solvant pour le nettoyage d'appareils mécaniques et électroniques
- agent gonflant pour la production de mousses plastiques
- Les halons, contenant du brome, ont été utilisés notamment comme produits extincteurs dans la lutte contre les incendies
A ces deux catégories de composés sont venues s'ajouter d'autres substances, également impliquées dans la dégradation de la couche d'ozone : - des solvants chlorés : le trichloréthane et le tétrachlorure de carbone
- le bromure de méthyle, un pesticide utilisé en horticulture. Son utilisation à des fins de quarantaine et de traitement avant expédition est encore autorisée en Europe afin de garantir l’absence d’organismes nuisibles dans les cultures commerciales, dans la mesure où des solutions de remplacement pour cette utilisation spécifique tardent à être développées (Commission européenne, 07/2005)
- les HCFC, HydroChloroFluoroCarbones et les HFC, HydroFluoroCarbones développés par l'industrie pour remplacer les CFC dans la plupart de leurs applications. Ils contiennent de l'hydrogène, ce qui provoque leur dégradation plus rapide dans la haute atmosphère. Ils attaquent la couche d'ozone mais moins longtemps que les CFC. Par contre, ils contribuent à accroître "l'effet de serre", un autre problème écologique très préoccupant.
L'atome de chlore avec une durée de vie pouvant atteindre la centaine d'années, détruira plusieurs milliers de molécules d'ozone avant de disparaître. Des facteurs naturels sont également à l'origine de l'appauvrissement de la concentration en ozone :
- le cycle des tâches solaires (11 ans) influe de 1 à 2 % entre le maximum et le minimum d'un cycle typique
- les émissions volcaniques d'aérosols de sulfate (Ex. juin 1991, l'éruption du mont Pinatubo aux Philippines)
- la vapeur d'eau contribue également à la destruction de l'ozone stratosphérique via les nuages (A. NICOLAS, 2004)
Les réponses et les solutions
Face à ce phénomène global et d'une extrême gravité, les pays industrialisés ont adopté un traité international : le protocole de Montréal le 16 septembre 1987 qui fait suite à la Convention de Vienne de mars 1985. Ce premier prévoyait de réduire la production de CFC de moitié pour l'an 2000 et est entré en vigueur en 1989.Cependant, avec l'urgence du problème, il est décidé en 1990, avec l'amendement de Londres puis celui de Copenhague en 1992, l'arrêt total de la production de CFC pour l'an 2000. Il a également été amendé en 1995 à Vienne, en 1997 à Montréal et en 1999 à Beijing.
Le protocole de Montréal
Depuis le 16 septembre 2009, le protocole de Montréal est ratifié par l'ensemble des 196 membres de l'ONU.Le protocole vise à protèger la couche d'ozone des dommages occasionnés par certaines substances chimiques industrielles connues sous le nom de substances appauvrissant l'ozone (SAO). Le protocole aura d'ici la fin de l'année 2009 interdit la production de réfrigérants et de solvants contenant des chlorofluorocarbones (CFC), ainsi que la fabrication d'extincteurs contenant des halons. Il a fixé un calendrier précis aux fins de l'élimination progressive d'autres substances nocives telles que les hydrochlorofluorocarbones (HCFC) et le bromure de méthyle.
Les premiers résultats
Suite au protocole, à ses amendements et à l'arrêt total de la production de CFC depuis 1994, les concentrations de produits appauvrissant l'ozone dans la basse atmosphère (la troposphère) ont atteint leur point culminant en 1995 et sont depuis en baisse dans la troposphère et la stratosphère. Les scientifiques estiment que les gaz ont atteint leur pic de concentration dans la stratosphère antarctique en 2001.Les CFC sont remplacés progressivement par d'autres gaz moins nocifs comme les hydrochlorofluorocarbures ou HCFC et hydrofluorocarbures ou HFC. Pour autant, l'abandon de toute substance chlorée et fluorée devra s'échelonner jusqu'en 2030 (IFEN, 2002).
Les substituts de première génération : les hydrochlorofluorocarbures (HCFC)
Ces composés (HCFC-22, HCFC-141, HCFC-142b) ont une durée de vie limitée à quelques dizaines d'années dans l'atmopshère. Cependant, ils contiennent encore du chlore qui contribue, certes plus modestement, à la diminution de la couche d'ozone.Leur production mondiale s'arrêtera en 2029. Au niveau de l'Union Européenne, leur utilisation est déjà restreintre et leur fabrication sera interdite en 2015.
Les substituts de deuxième génération : les hydrofluorocarbures (HFC)
Ces HFC (HFC-23, HFC-32, HFC-134a) ne contiennent pas de chlore, ils ne participent donc pas à la destruction de l'ozone atmopshérique.Par contre, leur utilisation nécessite la construction de nouveaux équipements industriels.
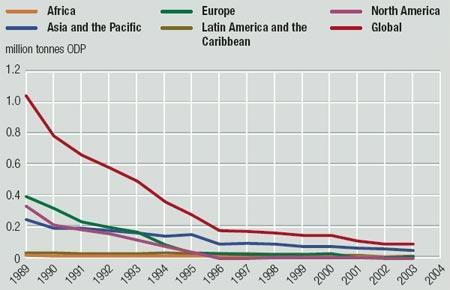 Déclin de la consommation de CFCs par grandes régions mondiales depuis 1988 avec l'adoption du protocole de Montréal. La consommation a été divisée par 8 passant de près de 800 000 tonnes en 1988 à 100 000 tonnes en 2001.
Déclin de la consommation de CFCs par grandes régions mondiales depuis 1988 avec l'adoption du protocole de Montréal. La consommation a été divisée par 8 passant de près de 800 000 tonnes en 1988 à 100 000 tonnes en 2001.Source : GEO Data Portal, d'après le secrétariat à l'ozone de l'UNEP - 2004L'Union européenne a progressivement éliminé plus de 99 % de sa production de SAO, grâce à la participation proactive du secteur industriel et à une stricte application de la législation communautaire relative aux SAO par la Commission et les États membres. À compter de 2010, des restrictions supplémentaires concernant les SAO entreront en vigueur au niveau de l'UE (UE; 09/2009).
L'adoption rapide du protocole de Montréal et la mobilisation unanime des pays producteurs de CFC est sans doute l'exemple le plus encourageant de notre capacité à nous mobiliser contre une atteinte grave à notre support de vie. Cependant, sur cette question, le consensus scientifique était sans équivoque, les conséquences clairement identifiées et les pays impliqués peu nombreux ; ce qui n'est pas le cas du changement climatique.
La résorption du trou réduit l'effet de serre
En diminuant notablement les concentrations en CFC, le protocole de Montréal a permis aussi d'atténuer l'effet de serre. En effet, les CFC sont aussi de puissants gaz à effet de serre. Grâce au protocole de Montréal, leur concentration sera en 2010 moitié moins importante qu'en l'absence de traité. Ainsi, c'est environ 11 Gt éqCo2 par an qui seront évités (OMM, 11/2008).Toutefois, les SAO sont de plus en plus remplacées par des hydrofluorocarbones (HFC), dont le potentiel de réchauffement planétaire est jusqu'à 14 800 fois plus élevé que celui du dioxyde de carbone, le principal gaz à effet de serre.
C'est pourquoi, en juillet 2009, les parties au protocole de Montréal ont engagé des discussions sur une proposition visant à limiter et à réduire la consommation mondiale de HFC.
Et demain ?
Il y a peu, les scientifiques considéraient que le trou dans la couche d'ozone devait se résorber totalement dans environ cinquante ans. Cependant, un nouveau rapport d'évaluation scientifique publié en août 2006 par l’Organisation météorologique mondiale et le Programme des Nations Unies pour l’environnement, indique que "la couche d'ozone situé au-dessus des latitudes moyennes, devrait se reconstituer d'ici à 2049, soit cinq ans plus tard que ne le laissait entendre la précédente évaluation (2002). Enfin, au-dessus de l'Antarctique, la reconstitution de la couche d'ozone ne devrait pas intervenir avant 2065, c'est-à-dire 15 ans plus tard que prévu."En savoir plus
Références
- L'actualité sur le trou dans la couche d'ozone
- Ozone Hole Watch - NASA
- Tous les chiffres sur le trou dans la couche d'ozone par le South Pole Ozone Program data (en anglais)
- Secrétariat de l'Ozone - Programme des Nations Unies pour l'Environnement
- Ozone Resource Page (en anglais) - NASA
- Liste des substances réglementées par le protocole de Montréal
- Nouvelles du Climat mondial - Organisation Météorologique Mondiale
- Journée internationale de la protection de la couche d'ozone
Auteur
- Christophe MAGDELAINE, responsable du site

