 C’est ce week-end, autour d’une table bien agréable, que je me suis rendu compte que beaucoup de monde parlait de CO2 sans connaitre réellement la méthode de calcul pour obtenir le taux d’émission de sa voiture. Le combat était amusant et chacun allait de sa propre théorie… et ce fut avec grande surprise que ce matin j’ai reçu par mail une analyse. Le plus subtile est que la personne m’envoyant ce mail n’était pas présent lors du débat.
C’est ce week-end, autour d’une table bien agréable, que je me suis rendu compte que beaucoup de monde parlait de CO2 sans connaitre réellement la méthode de calcul pour obtenir le taux d’émission de sa voiture. Le combat était amusant et chacun allait de sa propre théorie… et ce fut avec grande surprise que ce matin j’ai reçu par mail une analyse. Le plus subtile est que la personne m’envoyant ce mail n’était pas présent lors du débat.
Alors, prenez vos crayons et cahiers. « Sachant, que
Tout le monde en parle, rares sont ceux qui savent expliquer le calcul…
D’abord un peu de chimie :
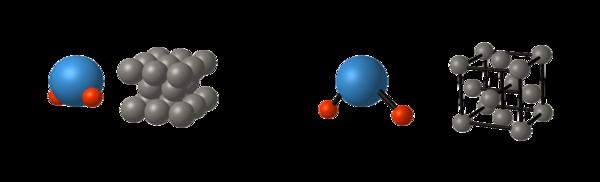
La matière est composée de sphères (dures) microscopiques qu’on appelle les atomes (Oxygène, hydrogène, carbone etc)
Ces atomes peuvent être regroupés en molécules : eau H2O, hydrocarbures CnHm composés de Carbone et d’Hydrogène selon la valeur de n et m les hydrocarbures sont différents
Réaction chimique : transformation de la molécule entre elles.
Après la réaction chimique on obtient d’autres molécules, mais avec les mêmes atomes que ceux constituant les molécules initiales.
On retrouve bien les mêmes atomes mais regroupés différemment.

La combustion complète du carbone produit uniquement du CO2
La combustion complète d’un hydrocarbure produit du CO2 et de l’eau H2O selon la formule :
CnH2n+2 +(3n+1)/2>nCO2+(n+1)H2O
Rappel des masses molaires : H=1g C=12g O=16g
Donc : Masse molaire du CO2 = 44g
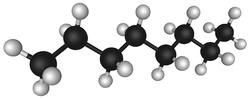
A l’état pur il est constitué d’atomes de carbone et d’atomes d’hydrogène dans une proportion 2n+2 atomes d’hydrogène pour n atomes de Carbone : formule C8 H18 pour l’octane
1 mole d’octane C8 H18 (8×12+18=114) donnera 8 moles de CO2 [8x12+(8x16x2)]=352
Chaque Kg d’octane produira : 352/114= 3,08 Kg de CO2
La production de CO2 est directement (uniquement) liée à la consommation d’hydrocarbures.
On peut calculer( affirmer) par exemple pour un carburant (GO) 1 Kg de C12 H26 produit 3,105 kg de CO2
La densité moyenne du GO étant de 0,845 Kg /litre, cela signifie qu’une voiture qui émet 140gr de CO2 au Km consomme 5,3 L/100 km. Il n’y a pas d’autre solution pour réduire l’émission de CO2 que de diminuer la consommation de carburant.
Exemple de calcul :
Le Gasoil : C12H26 (12×12 pour le carbone +26 pour l’hydrogène soit 170) se transforme en 12 CO2 (12×12+32 soit 528) chaque Kg de gasoil consommé produit 528 :170 = 3,105 Kg de CO2
Le Kg de gasoil équivaut :1 : 0,845 = 1,183 litres
Les 5,3 l/100km correspondent à : 5,3/1,183= 4,48 Kg de gasoil
Les 4,48 Kg de Gasoil (hydrocarbure) produisent : 4,48 x 3,105 = 13,91 kg de CO2 pour 100km soit 140g/km
Lors de l’homologation des véhicules l’UTAC définit par type de véhicules (norme 99/100 CE)
Cons. Urbaine )
Cons. Ex-urbaine ) en litres aux 100km
Cons. Mixte )
Emission de CO2 en g/km (exprimée pour la consommation mixte)
Les caractéristiques des carburants n’étant pas tout à fait constantes les calculs peuvent conduire à des résultats, très légèrement différents de la théorie.
Maintenant c’est à vous de faire vos calculs, et surtout faites nous part de vos résultats…
En ce qui me concerne je roule en velo…

Merci à Jack pour cette article…



LES COMMENTAIRES (2)
posté le 04 avril à 13:02
Combien de co² dégage la *construction *d'une automobile ? Merci
posté le 13 janvier à 18:48
ça c'est du rendement un moteur avale 4,48kg de gasoil et recrache 13.91kg de co2 est-ce que l'etat ne vient pas de d'inventer le moteur a co2 a moins que ce soit pour nous ponctionner de l'argent ? pour le moteur a co2 il me semble que pendant la derniere guerre il existait deja (en brulant du charbon de bois)