Ceci est la continuité naturelle de mon billet précédent intitulé La thermodynamique : Les Bases. Je vais vous présenter ici les 4 grands principes universels qui sont posés par la thermodynamique et qui ont permis la compréhension, la construction et l'amélioration des machines thermodynamiques comme la machine à vapeur, le moteur à essence, la pompe à chaleur ou le climatiseur.

Principe zéro
On l'appelle principe zéro car c'est ce principe qui permet l'étude de la thermodynamique en utilisant la variable température. Il peut être exprimé ainsi :
« La température est une grandeur physique repérable permettant de caractériser l'état d'un système »
Autrement dit : « On peut fabriquer un thermomètre ». Un corps est dit en équilibre thermique si sa température n'évolue pas dans le temps. Si 2 corps isolés sont en contact alors ils évoluent vers un équilibre thermique où ils auront la même température.
Premier principe
Le premier principe correspond à la conservation de l'énergie peut être formulé ainsi :
« Lors d'une transformation dans un système fermé, la variation d'énergie interne du système est égale à la quantité d'énergie échangée avec le milieu extérieur sous forme de chaleur et de travail »
On peut alors écrire mathématiquement que :
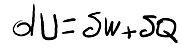
où dU représente la variation d énergie interne du système, dQ est une petite quantité de chaleur apportée au système et dW est une petite quantité de travail reçue par le système.
On peut résumer ce principe par la fameuse maxime : « Rien ne se perd, rien ne se créé, tout se
transforme » attribué à tord à Antoine Lavoisier puisque le philosophe présocratique Anaxagore de Clazomènes a écrit au 5ième siècle avant JC que : « Rien ne
naît ni ne périt, mais des choses déjà existantes se combinent, puis se séparent de nouveau ». On voit que la notion de conservation de l'énergie est très ancienne mais le premier
principe de la thermodynamique précise que l'énergie interne d'un système (somme des énergies microscopiques) peut être modifiée par apport ou par retrait de chaleur et de
travail.
On comprend ici l'intérêt de ce principe pour la construction de machines thermiques qui auront pour but de transformer la chaleur en travail (machine à vapeur, moteur, etc.) ou bien de transformer le travail en chaleur (pompe à chaleur, réfrigérateur, climatiseur, etc.).
Deuxième principe
C'est ce principe, formulé en 1865 par le physicien allemand Rudolf Clausius, qui introduit une nouvelle variable dénommée entropie et notée 'S'. Le deuxième principe est énoncé de la manière suivante :
« Toute transformation thermodynamique génère de l'entropie»
L'entropie est une grandeur extensive et est définit telle que sa variation lors d'une transformation réversible est égale à la quantité de chaleur apportée au système divisée par la température de ce même système, voir équation (1).
Si la transformation est irréversible, alors il y a une création d'entropie positive à cause des phénomènes dissipatifs (friction, diffusion, etc.), voir équation (2). On peut alors en déduire la fameuse inégalité de Clausius qui résume le second principe et qui est représentée dans l'inéquation (3) :
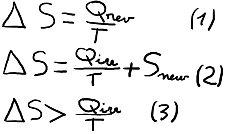
En réalité, une transformation réversible parfaite n'existe pas, toutes les transformations dites réelles sont irréversibles et elle créent de l'entropie. L'entropie totale de l'Univers est donc en perpétuelle augmentation depuis sa naissance. Cet énoncé est capital en thermodynamique et a de nombreuses retombés au niveau scientifique mais également au niveau philosophique.
Pour la construction de machines thermiques, il faut comprendre avec ce principe que la génération d'entropie est
un problème car cette entropie créée va venir diminuer le rendement des machines. Autrement dit, il faut fabriquer des machines qui minimisent la création d'entropie, c'est-à-dire qui
minimise principalement les pertes par frictions. On comprend naturellement qu'un moteur qui tourne très vite va avoir un meilleur rendement si les frottements sont
minimes.
Troisième principe
Ce principe, également appelé principe de Nernst fut énoncé en 1904 :
« Si la température d'un système tend vers le zéro absolu, alors l'entropie tend vers zéro »
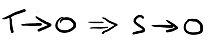
Les fondements et les implications de ce principe, liés à la physique quantique, sont complexes mais n'ont pas d'incidence sur la thermodynamique classique et la construction de machines thermiques. Je ne rentrerai donc pas dans les détails ici.
Les machines thermiques
Une machine thermique peut répondre à 2 fonctions principales :
- Transformer la chaleur en travail (faire bouger un objet à partir de chaleur) : Machine à vapeur, moteur
thermique (moteur à explosion, essence, diesel, alcool ou gaz dans les voitures, moteurs à réaction dans les avions), etc.
- Transformer le travail en chaleur (faire du chaud ou du froid à partir d'un objet qui bouge) : Pompe à chaleur, réfrigérateur, climatiseur, etc.

Les machines thermiques sont basées sur un ensemble de transformations thermodynamiques que l'on vient faire subir
à un fluide de manière cyclique. Dans notre étude thermodynamique, ce fluide est alors notre système qui va venir échanger de la chaleur et du travail avec le milieu
extérieur .
- Dans la machine à vapeur, le fluide en question est de l'eau que l'on vient en général chauffer
à l'aide d'une chaudière à charbon pour évaporer l'eau (apport de chaleur). La vapeur d'eau actionne alors un piston qui va entrainer une roue par l'intermédiaire d'un vilebrequin et
provoquer un mouvement de rotation (création de travail). Illustration d'une machine à vapeur (source :
Wikipédia) :
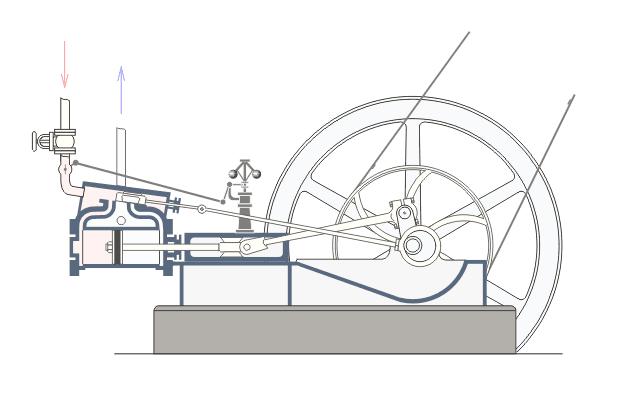
- Dans les réfrigérateurs on utilise un fluide dit "frigogène" comme fluide caloporteur (qui transporte la chaleur). On utilisait du fréon au tout début mais maintenant ce sont des fluides complexes comme le dichlorodifluorométhane, le tétrafluoroéthane ou le méthylpropane qui sont moins nocifs pour l'environnement. Le principe général du réfrigérateur est de compresser un fluide à l'aide d'un compresseur (apport de travail) et d'effectuer ensuite une détente (diminuer la pression du fluide brutalement) pour faire du froid. Les climatiseurs sont basés sur le même principe et les pompes à chaleur sont simplement des climatiseurs qui fonctionnent 'à l'envers'. Un futur billet sera dédié aux machines frigorifiques.
Par commodité, on représente ces transformations dans des diagrammes qui peuvent être de différentes natures. Un des plus connus est le diagramme de Clapeyron qui représente l'évolution de la pression et du volume du fluide pendant les transformations. Ainsi, chaque ligne entre 2 points du diagramme correspond à une transformation réalisée par un équipement particulier (échangeur de chaleur, vanne, turbine, piston ...) entre 2 états du fluide.
Le Cycle de Carnot
Au début du 19ième siècle, Sadi Carnot, célèbre physicien et ingénieur français, établit le cycle
thermodynamique idéal pour obtenir du travail mécanique à partir d'une source chaude et d'une source froide : le cycle de Carnot. Les recherches de Carnot étaient vitales à son
époque pour fabriquer des machines à vapeurs optimales en améliorant les rendements et c'est également lui le premier à formuler de manière scientifique le principe du moteur thermique sur lequel
tous les moteurs thermiques sont aujourd'hui construits dans les voitures et les avions (moteurs à explosion et moteurs à réaction).
Ce cycle étant réversible, si on le prend dans le sens inverse, il est aussi le cycle idéal pour échanger de la chaleur d'une source chaude à une source froide à partir d'une source de travail donnée. Autrement dit : c'est le cycle de réfrigération idéal !
Le cycle de Carnot est constitué d'un ensemble de 2 transformations adiabatiques réversibles (pas d'échange de chaleur avec l'extérieur à entropie constante) et de 2 transformations isothermes (température constante). Dans le sens des aiguilles d'une montre, c'est un cycle moteur et les transformations sont les suivantes :
- De A à B : Compression isotherme où une chaleur Q1 est extraite du système vers la source
froide qui est à une température T1 (donc Q1<0)
- De B à C : Compression adiabatique réversible (isentropique)
- De C à D : Détente isotherme où une chaleur Q2 est apporté au système via une source chaude qui
est à la température T2 (donc Q2>0)
- De D à A : Détente adiabatique réversible (isentropique)
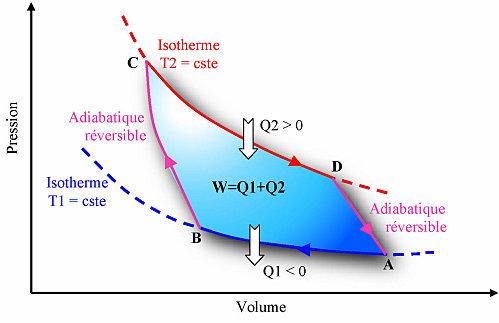
Le cycle de Carnot moteur dans le diagramme de Clapeyron (Pression en fonction du Volume)
Au total, ce cycle produit un travail mécanique W = Q1+Q2 ainsi qu'une quantité de chaleur Q1 pour une quantité de chaleur apportée égale à Q2 et c'est le meilleur cycle possible entre une source chaude et une source froide.
Si on applique le 2ième principe de la thermodynamique sur ce cycle en disant qu'il est idéal (transformation adiabatiques réversibles, donc à entropie constante), on peut faire un bilan entropique du cycle.
- Pendant la transformation de A à B, l'entropie extraite du système est égale à la quantité de chaleur Q1 négative divisé par T1, voir équation (1)
- Pendant la transformation de C à D, l'entropie apportée au système est égale à la quantité de chaleur Q2 positive divisée par la température de la transformation, soit T2, voir équation (2)
- Les 2 autres transformations sont des transformations adiabatiques réversibles donc l'entropie reste constante. On peut alors dire que l'entropie perdue entre A et B est égale à l'entropie gagnée entre C et D, voir l'équation (3) qui symbolise l'équation de Clausius-Carnot et qui définit ainsi les chaleurs nécessaires à échanger entre une source chaude (à la température T2) et source froide (à la température T1).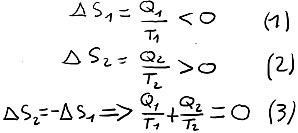
Exemple avec cycle de Carnot
On considère une sorte de machine à vapeur idéale qui utilise l’eau comme fluide et qui serait basée sur un cycle de Carnot (impossible à réaliser). Dans notre machine fictive, la source froide est à la température ambiante, soit T1= 20°C = 293 kelvin. La source chaude est à la température de la vapeur d’eau qui est donc T2= 100°C = 373 kelvin. Si on apporte une quantité de chaleur Q2=500 watt , alors la quantité de chaleur extraite du système est selon l’équation de Clausius-Carnot égale à Q1 = - T1 * (Q2/T2) = - 293 * (500/373) = -393 Watt. Le travail fournit est donc égale à W=Q1+Q2 = 500 – 393 = 107 Watt.
Ceci signifie qu’entre 20°C et 100°C, si on apporte une quantité de chaleur de 500 Watt, on pourra extraire dans le meilleur des cas une puissance mécanique de 107 Watt, le rendement optimal est donc n = W/Q2 = 107/500 = 21%. La physique nous apprend donc qu’il est impossible de fabriquer une machine thermique avec un rendement supérieur à 21% entre 20°C et 100°C. Plus généralement on peut démontrer que le rendement pour une machine de Carnot ne dépend que des températures chaude et froide et que ce rendement est égal à :
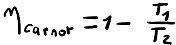
Toutes les machines thermodynamiques tentent de se rapprocher du cycle de Carnot mais il est inatteignable en partie à cause du deuxième principe de la thermodynamique qui dit que toute transformation génère de l’entropie. Les transformations isentropiques (adiabatiques réversibles) sont alors impossibles, de même que les compressions isothermes car lorsqu’on comprime un gaz, on vient générer de la chaleur à cause des frictions, ce qui a pour effet d’augmenter la température du système.
A titre d’exemple, un moteur thermique essence fonctionne entre 20°C (293 K) et 500°C (773 K) environ, son rendement de Carnot est donc de 1-273/773 = 62%. En réalité, un moteur à essence possède un rendement d’environ 36% en fonctionnement optimal et de 15% en fonctionnement dégradé (en ville par exemple) à cause de la génération d’entropie dans les différentes transformations et de la génération de chaleur lors de la compression.
par Benjamin Bradu publié dans : Science/Philo/Religionajouter un commentaire 0 commentaire (0) commentaires (0) créer un trackback recommander Précédent : La thermodynamique : les bases Retour à l'accueil


LES COMMENTAIRES (1)
posté le 29 août à 15:55
le Watt est une unité de mesure de la puissance et non pas de l'énergie...