Functional telomere = Télomère fonctionnel
Sustained cell proliferation = Prolifération cellulaire soutenue
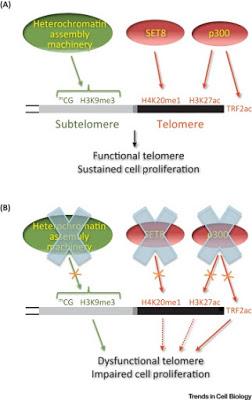
Le paysage épigénétique des Régions Télomériques Humaines Influence la Fonction des Télomères et la Prolifération Cellulaire. (A) Marques épigénétiques des régions télomériques des cellules humaines en prolifération. La plupart des lignées cellulaires humaines communément étudiées présentent des subtélomères hétérochromatiques et sont étiquetées H4K20me1 et H3K27ac au niveau des télomères. Alors que SET8 est à l’origine de H4K20me1, c’est p300 qui devrait être à l’origine de H3K27ac, et qui fait le lien avec les télomères et acétyle TRF2ac . (B) Influence du paysage épigénétique des régions télomériques sur la prolifération cellulaire. L’interruption de l’hétérochromatine subtélomérique par mutation de la machinerie d’assemblage de l’hétérochromatine ou le traitement avec des inhibiteurs de la méthylation de l’ADN ou de l’acétylation des histones ; mène à des télomères dysfonctionnels et une altération de la prolifération cellulaire. De la même façon, l’interruption ou l’inhibition de p300 et SET8 à la fois mène à une altération de la prolifération cellulaire, qui pourrait être influencée par leur contribution à l’établissement de marques télomériques (indiquée par des flèches discontinues). Dans le cas de p300, la dysfonction télomérique contribue à une prolifération cellulaire due, au moins en partie, à un défaut d’acétylation TRF2.
L’intégrité de la chromatine associée aux régions télomériques, qui incluent les télomères et les subtélomères, est essentielle à la fonction des télomères et de la viabilité cellulaire. Alors que les subtélomères humains sont hétérochromatiques, les télomères sont étiquetés par des régions euchromatiques comme HK20me1 et H3K27ac dans la plupart des lignées cellulaires communément étudiées. Les marques épigénétiques des régions télomériques humaines agissent sur les processus oncogéniques. En effet, différents médicaments qui font baisser les taux au niveau du génome entier sont actuellement utilisés ou testés comme thérapies spécifiques contre le cancer. Ces médicaments défient le cancer en altérant la fonction des protéines cellulaires clé. Cependant, ils pourraient avoir aussi pour effet d'entraver les processus oncogéniques en modifiant le paysage épigénétique des régions télomériques. Nous pensons que les études sur la structure de la chromatine télomérique et sur le dysfonctionnement des télomères devrait aider à la mise au point de thérapies épigénétiques pour le traitement du cancer. Maria Isabel Vaquero-Sedas, et Miguel Àngel Vega-Palas, dans Trends in Cell Biology, publication en ligne en avant-première, 16 janvier 2019Source iconographique, légendaire et rédactionnelle : Science Direct / Traduction et adaptation : NZ
